А. А. Вильцанюк, М. В. Мазур
Винницкий национальный медицинский университет им. Н.И. Пирогова
ОБОСНОВАНИЕ ЭФФЕКТИВНОСТИ ПРИМЕНЕНИЯ РЕКТАЛЬНЫХ СУППОЗИТОРИЕВ «ДАЛМАКСИН» (ТИОТРИАЗОЛИН) В КОМПЛЕКСНОМ ЛЕЧЕНИИ ОСТРОГО ПАРАПРОКТИТА
Резюме. Проблема лечения острого гнойного парапроктита является одной из наиболее актуальных проблем современной колопроктологии.
Цель исследования. Провести оценку эффективности использования ректальных суппозиториев «Далмаксин» в комплексном лечении острого парапроктита.
Материалы и методы. Эффективность использования ректальных суппозиториев «Далмаксин» проверена у 62 больных с острым подкожным парапроктитом, которые были разделены на две группы: основную – 30 больных, и группу сравнения – 32 больных. Всем больным проводилось радикальное оперативное вмешательство. После операции назначали антимикробную, дезинтоксикационную и симптоматическую терапию. Местное лечение гнойных ран проводилось с использованием мазей на гидрофильной основе, больным основной группы дополнительно назначали ректальные суппозитории Далмаксин два раза в сутки. Эффективность лечения оценивали по выраженности отека, характеру выделений из раны, уровню микробного загрязнения, срокам очищения ран, появлению грануляционной ткани и эпителизации, и с помощью цитологического исследования. Эндогенную интоксикацию (ЭИ) и ее динамику в процессе лечения, оценивали по уровню молекул средней массы, лейкоцитарному индексу интоксикации и гематологическому показателю интоксикации. Статистическая обработка и сравнение полученных данных проведены с помощью интегральной системы STATISTICA® 5.5(STAT+SOFT® Snc, USA), лицензия А XX 910A374605FA.
Результаты. Проведенное исследование показало, что у больных острым парапроктитом тяжесть течения послеоперационного периода обусловлена присутствием тяжелой интоксикации и развитием синдрома системного воспалительного ответа, которые были обнаружены у больных на момент госпитализации. После оперативного вмешательства, только с пятых суток начиналось постепенное снижение показателей уровня ЭИ и лабораторных показателей. При сравнении полученных результатов лечения острого парапроктита у больных с использованием ректальных суппозиториев «Далмаксин» с традиционными методиками, выявлено, что течение послеоперационного периода в этой группе больных имело более благоприятное течение. Сроки пребывания больных в стационаре также были меньше, чем в группе сравнения и составляли (9,2±0,5) против (11,9±0,9) койко-дней.
Выводы. Проведение сравнительной оценки использования «Далмаксина» в комплексном лечении острого гнойного парапроктита показало, что препарат за счет своих свойств значительно улучшает течение послеоперационного периода, о чем свидетельствовало более быстрое снижение эндогенной интоксикации, уменьшение микробной загрязненности и очищение ран от некротических тканей, более раннее появление грануляций, эпителизация и заживление ран и тем самым способствует сокращению сроков пребывания больных в стационаре
Ключевые слова: острый парапроктит, комплексное лечение, тиотриазолин, ректальные суппозитории «Далмаксин».
Вступление
В последние десятилетия в Украине, как и в большинстве цивилизованных стран мира, отмечается рост показателей заболеваемости колопроктологической патологией, доля которой в структуре болезней органов пищеварения составляет 15% [World Gastroenterology Organisation, 2016]. Наиболее распространенными заболеваниями анального канала и тканей промежности на сегодняшний день являются геморрой, анальные трещины, свищи прямой кишки и острый парапроктит, составляющие от 20 до 41% от общего числа других колопроктологических заболеваний [1, 2, 3]. На сегодняшний день больные с острым парапроктитом занимают четвертое место после геморроя, анальной трещины и колита, которые составляют 38-41% пациентов с экстренной хирургической патологией толстой кишки, и по данным разных авторов – от 10 до 50% всех колопроктологических заболеваний [4].
Несмотря на внедрение современных методик лечения острого парапроктита, у 13-20% больных в послеоперационном периоде возникает большое число осложнений [5, 6]. Без сомнения, основным методом лечения этой патологии остается хирургический метод, но течение послеоперационного периода требует применения комплексного подхода и целого ряда средств, которые помогают избежать осложнений и обеспечить выздоровление больных [7, 8, 9]. При этом особого внимания требует ведение послеоперационного периода у больных с сопутствующей патологией, и особенно – у больных с иммуносупрессией, лечение которых после операции требует назначения препаратов, обладающих политропным действием [9. 10, 11].
Таким веществом отечественного производства является соль тиазотной кислоты, разработанная сотрудниками НПП «Фарматрон» и Запорожского медицинского университета, и широко используемая в различных отраслях медицины [12]. Одной из лекарственных форм тиотриазолина являются ректальные свечи «Далмаксин», которые используются в гинекологии при лечении воспалительных заболеваний органов малого таза [13]. Но до сих пор, практика использования Далмаксина в колопроктологии при лечении острого парапроктита, широкого распространения еще не получила.
Цель исследований
Провести оценку эффективности применения ректальных суппозиториев Далмаксин в комплексном лечении острого парапроктита.
Материалы и методы исследований
Исследование эффективности применения ректальных суппозиториев «Далмаксин» в комплексном лечении острого парапроктита и острого подкожного парапроктита, проведено у 62 больных в возрасте от 19 до 68 лет, из которых женщин было 12 (19,4%), мужчин 50 (80,6%). Больные были распределены на две группы: основную – 30 больных и группу сравнения – 32 больных. Всем пациентам проводилось радикальное оперативное вмешательство, которое заключалось в следующем: после проведения адекватного обезболивания, проводили раскрытие гнойного очага и ликвидацию внутреннего отверстия в области анальной крипты. Полости гноя подвергались ревизии, при этом выявлялись заплывы и карманы, которые при необходимости раскрывались дополнительными разрезами, удалялись остатки некротических тканей. После этого проводили санацию полостей гноя растворами антисептиков и дренировали резиновыми дренажами или полихлорвиниловыми трубками.
После проведения радикального оперативного вмешательства и обработки гнойного очага, больным назначали парентеральное введение антибиотиков, дезинтоксикационную и симптоматическую терапию. Местное лечение гнойных ран в послеоперационном периоде у больных обеих групп проводилось с использованием мазей на гидрофильной основе, в зависимости от фаз раневого процесса [14]. Больным основной группы дополнительно назначали ректальные суппозитории «Далмаксин», которые ставились в прямую кишку два раза в сутки на протяжении всего срока пребывания в стационаре, а в дальнейшем – до 14 суток.
Эффективность лечения больных в послеоперационном периоде оценивали по общепринятым клиническим критериям (общее состояние, признаки интоксикации, температура тела), динамике течения раневого процесса (выраженность перифокального отека, инфильтрации тканей, характер выделений из раны, сроки очищения ран, появления грануляционной ткани и эпителизации). Кроме этого, оценивались данные лабораторных исследований, которые включали изучение бактериологического загрязнения ран, цитологического исследования ран по методикам, согласно рекомендациям Даценко Б. М. [15].
Всем больным перед операцией и в послеоперационном периоде проводились общие лабораторные и биохимические исследования в следующем объеме: общий анализ крови с определением уровня гемоглобина, цветового показателя, количества эритроцитов и лейкоцитов, лейкоцитарной формулы, скорости оседания эритроцитов; общий анализ мочи с изучением физико-химических свойств и проведением микроскопического исследования осадка, количественное определение белка проводилось способом Стольникова, сахара – поляриметрическим методом. В рамках биохимических исследований определялся общий белок сыворотки крови биуретовой реакцией, креатинина – по реакции Яффе (метод Поппера), мочевины – по цветной реакции с диацетилмонооксимом, наборами «БасБета» [16, 17].
Эндогенную интоксикацию (ЭИ) и ее изменения в ходе лечения оценивали по уровню молекул средней массы (МСМ) в сыворотке крови, которые определяли спектрофотометрическим методом при длине волны 254 нм и представляли в условных единицах (УЕ), равных единице экстинкции [18]. Лейкоцитарный индекс интоксикации (ЛИИ) и гематологический показатель интоксикации (ГПИ) определяли по методикам Каль-Калифа и Васильева [19, 20]. Статистическую обработку полученных данных проводили с определением средних величин. Результаты, полученные в разных группах больных, сравнивали, для определения их отличий использовали t-критерий Стьюдента [21]. Для проведения статистической обработки собранных данных использовалась интегральная система STATISTICA® 5.5 (STAT+SOFT® Snc, USA), номер лицензии А XX 910A374605FA.
Результаты исследований и их обсуждение
На момент госпитализации, общее состояние у больных основной группы и группы сравнения было тяжелым. Беспокоили боли в прианальной области, отмечались повышение температуры тела, тахикардия, общая слабость, жажда, нарушения сна. При лабораторном исследовании отмечался нейтрофильный лейкоцитоз, повышение СОЭ и изменение показателей биохимических исследований. Показатели ЭИ у всех госпитализированных больных в результате патологического процесса были высокими. Так, на момент госпитализации, уровень МСМ составлял (0,467+0,02) ед. экст., ЛИИ — (6,43±0,24) усл.ед. После проведенного оперативного вмешательства общее состояние больных несколько улучшалось, но в целом оставалось тяжелым. Температура тела в обеих группах больных оставалась повышенной, на уровне 37,5-38,0 °С. Послеоперационные раны были с некротизированными тканями. Существенных изменений в крови при лабораторных исследованиях не наблюдалось, микробная загрязненность ран была на уровне 107 КОЕ/г ткани и составляла (4,0±0,8)х107 в основной группе и (3,9±0,3)х107 КОЕ/г ткани в группе сравнения.
После вскрытия гнойных очагов, цитологическая картина в мазках–отпечатках, взятых из послеоперационных ран, до проведения местного лечения, у больных обеих групп носила воспалительный характер. При микроскопическом исследовании у (91,0+2,9)% выявлялись преимущественно нейтрофильные лейкоциты с дегенеративными изменениями. Количество неповрежденных клеток в мазках-отпечатках составляло всего (8,4±1,2)%, выявлялись единичные макрофаги, количество которых составляло всего (0,5±0,3)%. Микроорганизмы свободно располагались между измененными нейтрофильными лейкоцитами, выявлялись нити фибрина и значительное количество тканевого детрита. Фагоцитарная активность нейтрофилов практически отсутствовала. При микроскопии, в отдельных полях зрения, встречались одиночные лейкоциты с фагоцитированными, но не переваренными бактериями.
На третьи сутки после операции, общее состояние больных обеих групп улучшалось, утром температура тела снижалась до 37,1°С, но в вечернее время еще повышалась до 37,5°С. Повязки продолжали промокать серозно-гнойным отделяемым. Послеоперационные раны были с некротическими тканями, но в основной группе у отдельных больных раны частично очищались от некротических тканей и появлялись островки грануляций. В обеих группах больных уровень ЭИ оставался повышенным. Уровень МСМ в периферической крови оставался повышенным, как в основной группе, так и в группе сравнения, и достоверно не отличался от показателей, полученных перед операцией. Но в основной группе он был несколько ниже, чем в группе сравнения и составлял (0,454±0,012) ед. экст. против (0,469±0,08) ед. экст. ЛИИ также был на довольно высоком уровне и составлял (5,34 ± 0,9) усл. ед., тогда как в группе сравнения – (6,63 ± 0,8) усл. ед. Показатель ГПИ также снижался, и достоверно (р<0,05) отличался от показателей на момент госпитализации, но в основной группе он был достоверно (р<0,05) ниже, чем в группе сравнения и составлял (16,9±1,8)) усл. ед., против (17,9±2,51) усл. ед.
В мазках-отпечатках из ран у больных группы сравнения, количество неизмененных нейтрофильных лейкоцитов возрастало до (33,0±2.3)%, количество дегенеративно измененных клеток уменьшалось до (65,0±0,7)%, появлялись единичные фагоцитарно активные клетки, но фагоцитоз в массе своей имел незавершенный характер. Цитологическая картина свидетельствовала о начале регенераторных процессов: появлялись незрелые мононуклеары – до (1,5 ± 0,6)%, хотя их количество достоверно не отличалось (р<0,05) от предыдущего срока наблюдений, встречались единичные фибробласты. В мазках-отпечатках наблюдались свободно расположенные бактерии в виде скоплений, отмечалось присутствие нитей фибрина и тканевого детрита. В основной группе, на третьи сутки после операции, процент неповрежденных нейтрофилов составлял (79,0±3,95), дегенеративно измененных нейтрофилов — (9,0±0,7)%, а количество фагоцитарно активных клеток составляло (1,5±0,3)%. В этих клетках отмечался завершенный фагоцитоз, в то время как в (25,0±0,3)% клеток, фагоцитоз оставался незавершенным. Незрелые мононуклеары составляли (4,5±0,6)%, макрофаги – (3,5 ± 0,1) %, что было достоверно выше (р<0,05), чем в группе сравнения. В отличие от группы сравнения, в основной группе, на тот же момент наблюдения, в мазках отпечатках выявлялись единичные нити фибрина и незначительное количество тканевого детрита.
На 5-6 сутки после операции, общее состояние больных было удовлетворительным. Температура тела в группе сравнения была на уровне 37,3°С, в то время как у больных основной группы составляла 36,9°С. Инфильтрация тканей вокруг послеоперационной раны начинала обратное развитие, и в основной группе почти не определялась. В группе сравнения инфильтрация тканей хотя и уменьшилась, но в тканях вокруг послеоперационной раны еще определялась. Количество выделений из раны уменьшилось, и они носили серозный характер. Послеоперационные раны в основной группе очищались от некротических тканей и были покрыты грануляционной тканью, появлялись признаки краевой эпителизации ран. В группе сравнения послеоперационные раны также очищались от некротических тканей, но у всех больных в ранах определялись участки с некротическими тканями, а в местах, где не было некротических тканей, обнаруживались дряблые грануляции. Микробная загрязненность послеоперационных ран в основной группе была на уровне (1,9±103) КОЕ/г ткани и (2,5±104) КОЕ/г ткани в группе сравнения, что было достоверно выше (р<0,05) чем в основной группе. Наряду с улучшением общего состояния больных, на 5-е сутки после операции улучшились и показатели ЭИ. Так уровень МСМ в основной группе снижался до (0,345±0,019) ед. экст. против (0,408±0,05) ед. экст., в группе сравнения и был достоверно (р<0,05) ниже, чем в группе сравнения. ЛИИ в основной группе был достоверно ниже (р<0,05) чем в группе сравнения и составлял (3,86±0,1) усл. ед. против (4,32±0,3) усл. ед. в группе сравнения.
Достоверно быстрее снижался и ГПИ. Его уровень в основной группе был в пределах (10,7±1,1) усл. ед., а в группе сравнения — (12.8±2,1) усл. ед. В пользу активации процессов репаративной регенерации, в основной группе свидетельствовали данные цитологического исследования. Цитограммы постепенно приобретали регенераторный характер в обеих группах, при этом процессы эти были более выраженными в основной группе, где больные в послеоперационном периоде получали «Далмаксин».
На 5-е сутки наблюдения, у пациентов из группы сравнения цитологическая картина раневого экссудата почти не отличалась от предыдущего срока наблюдения, хотя количество неповрежденных нейтрофилов вырастало до (48,5±3.1)% и увеличивалось количество фагоцитирующих клеток, но преобладал незавершенный фагоцитоз. На этот момент наблюдения количество незрелых мононуклеаров увеличивалось до (2,0±0,3)%, увеличивалось число макрофагов до (1,5±0,15)% и количество фибробластов. Уменьшалось и количество бактерий, хотя иногда отмечались их небольшие скопления. Также в мазках-отпечатках уменьшалось количество нитей фибрина и тканевого детрита, тогда как в основной группе на 5 сутки наблюдения, количество нейтрофильных лейкоцитов в раневом содержимом достоверно уменьшалось (р<0,05) по сравнению с предыдущим сроком наблюдения, при этом 80% клеток было без дегенеративных изменений и в основной массе клеток наблюдался активный фагоцитоз. В сравнении с группой больных, которым проводилось обычное лечение, достоверно (р<0,05) вырастало количество незрелых мононуклеаров до (7,5±0,3)%, а также макрофагов до (5,0±0,1). Кроме этого, количество юных фибробластов достигало (3,5±0,07) %, а зрелых – (2,5±0,3)%, появились фиброциты, количество которых составляло (1,0±0,02)%. Микроорганизмы свободно располагались между клеточными элементами, встречались в отдельных полях зрения в виде единичных клеток. Аналогично, как у больных в группе сравнения, встречались отдельные нити фибрина, но тканевой детрит отсутствовал.
На 7-е сутки послеоперационного периода общее состояние больных в обеих группах значительно улучшалось, в сравнении с предыдущими сроками наблюдения, температура тела была на уровне нормальных показателей. Показатели ЭИ в основной группе существенно отличались от показателей в группе сравнения и составляли: МСМ (0,268±0,017) ед. экст. против (0,301±0,015) ед. экст., ЛИИ — (2,03±0,2) против (3,07±0,4) усл. ед., ГПИ — (3,4±0,9) усл. ед. против (4,9±0,71) усл. ед. Гиперемия, отек и инфильтрация окружающих тканей в основной группе больных не наблюдалась, но в группе сравнения у 5 больных еще имелась незначительная инфильтрация тканей. Послеоперационные раны в основной группе полностью очистились от некротических тканей и заполнялись сочными, алыми грануляциями. Наблюдалась интенсивная краевая эпителизация, а в группе сравнения процессы краевой эпителизации были менее выраженными. Если в основной группе цитограммы имели явно регенераторный характер, и микробная загрязненность ран характеризовалась наличием единичных бактерий, то в группе сравнения микробная загрязненность ран составляла (2,8±0,7)х102 КОЕ/г ткани, кроме того, у отдельных больных на раневой поверхности выявлялись островки из некротизированных тканей, что подтверждалось данными цитологического исследования.
В мазках-отпечатках число нейтрофильных гранулоцитов уменьшалось, хотя у 27-32% остались дегенеративно измененные формы и наблюдался незавершенный фагоцитоз. Количество незрелых мононуклеаров возрастало до (2,3±0,1)%, а макрофагов – до (2,5±0,25)%. Число фибробластов также возрастало в сравнении с данными предыдущего наблюдения, хотя они были представлены преимущественно юными формами (их количество достигало (1,3±0,1)%). Количество микроорганизмов уменьшалось, хотя в отдельных полях зрения они наблюдались в виде небольших скоплений. Нитей фибрина не обнаруживалось, но встречались небольшие участки, где содержался тканевый детрит и только к 10-м суткам наблюдения цитограммы приобретали регенераторный характер. Тогда как в основной группе больных, на 7-е сутки наблюдения цитологическая картина имела чисто регенераторный характер. Количество лейкоцитов в мазках-отпечатках достоверно уменьшалось (р<0,05) от всех предыдущих сроков наблюдения, дегенеративно измененные нейтрофилы не выявлялись. Незрелые мононуклеары составляли (8,5±0,2)%, макрофаги – (6,0±0,5)%. Количество фибробластов в мазках-отпечатках увеличивалось до 13%, при этом юные формы составляли (4,0±0,3)%, зрелые (5,5±0,01)%, а фиброциты – (3,5±0,2)%. Бактерии, нити фибрина и тканевый детрит не выявлялись.
На итоговые сроки наблюдения, показатели ЭИ в основной группе были на уровне нормальных показателей, или приближались к норме и составляли: МСМ (0,244±0,014) ед. экст., ЛИИ — (0,9±0,01) усл. ед. и ГПИ — (2,1±0,4) усл. ед., тогда как в группе сравнения эти показатели оказались достоверно выше, чем в основной группе и составляли: МСМ – (0,263±0,01), ЛИИ – (1,1±0,02) усл. ед. и ГПИ — (3,4±0,67) усл. ед. (рис. 1, 2).
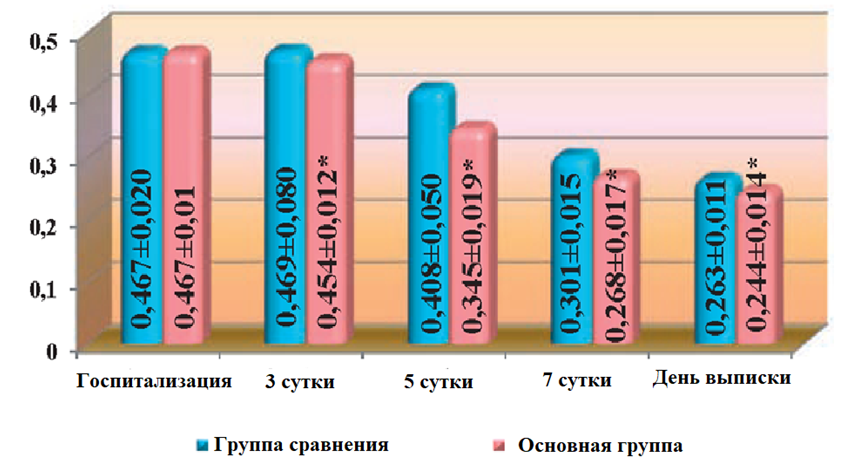
Рис. 1. Сравнительная оценка динамики изменений уровня метаболитов средней массы (МСМ) в крови у больных при лечении острого парапроктита с использованием ректальных суппозиториев «Далмаксин».
Примечание. *разница достоверна (p<0,05) в сравнении с группой больных, не получавших «Далмаксин».
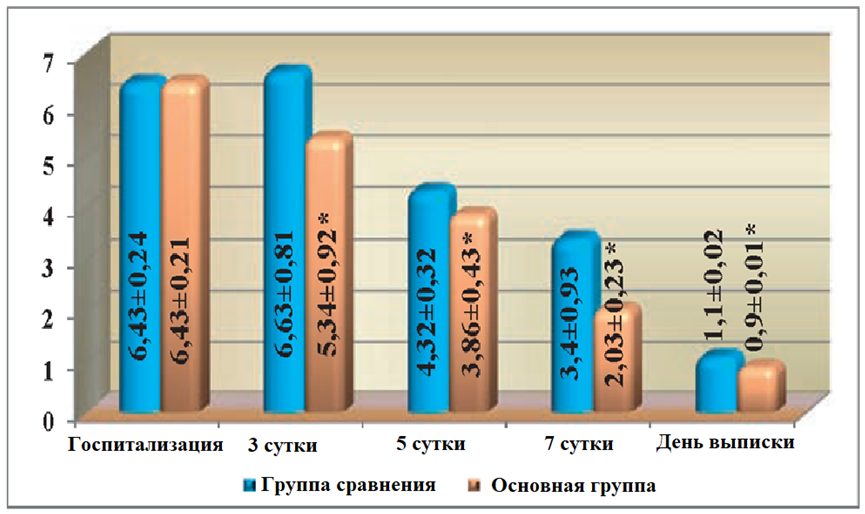
Рис. 2. Сравнительная оценка динамики изменений уровня лейкоцитарного индекса интоксикации (ЛИИ) в крови у больных при лечении острого парапроктита с использованием ректальных суппозиториев «Далмаксин».
Примечание: *разница достоверна (p<0,05) в сравнении с группой больных, не получавших «Далмаксин».
Сравнивая полученные результаты лечения острого гнойного парапроктита у больных с использованием ректальных суппозиториев «Далмаксин», и при использовании традиционных методик, выявлено, что течение послеоперационного периода в этой группе больных значительно отличалось и имело более благоприятное течение (табл. 1).
Как видно из полученных данных, если инфильтрация тканей вокруг ран в группе сравнения сохранялась до (6,2±1,4) суток, то в основной группе – до (4,8±1,3) суток. Уровень микробной загрязненности ран был ниже критического уровня на 5-е сутки, тогда как в группе сравнения, при исследовании на 7-е сутки, очищение ран от некротических тканей происходило в среднем через (7,5±1,4) суток, а в основной – через (5,0±1,5) суток. В основной группе больных, раны заполнялись грануляциями и начиналась краевая эпителизация достоверно раньше (р<0,05), чем в группе сравнения. Средние сроки пребывания больных в стационаре также были достоверно ниже (р<0,05) чем в группе сравнения и составляли (9,2±0,5) против (11,9±0,9) койко-дней, что почти на 3 койко-дня меньше, чем в группе сравнения.Таблица 1. Сравнительная оценка результатов лечения острого парапроктита с использованием ректальных суппозиториев «Далмаксин».
| № п/п | Название показателя | Группа сравнения (n=32) | Основная группа (n=30) |
| 1. | Инфильтрация тканей | 6,2 ± 1,4 | 4,8 ± 1,3* |
| 2. | Очищение ран от некротических тканей | 7,5 ± 1,4 | 5,0 ± 1,5* |
| 3. | Эпителизация ран | 7,0 ± 0,5 | 5,4 ± 1,0* |
| 4. | Срок пребывания больных в стационаре | 11,9 ± 0,9 | 9,2 ± 0,5 * |
Примітка: * різниця достовірна (р<0,05) у порівнянні з групою хворих, які не отримували «Далмаксін».
Проведене дослідження показало, що у хворих на гострий парапроктит важкість перебігу післяопераційного періоду обумовлена наявністю важкої інтоксикації та розвитком синдрому системної запальної відповіді, які були виявлені у хворих на момент госпіталізації. При цьому, навіть після проведеного оперативного втручання, в перші п’ять діб післяопераційного періоду, нормалізації клініко-лабораторних показників не відбувається і тільки з п’ятої доби післяопераційного періоду відбувалось поступове зниження показників рівня ЕІ, які на момент виписки наближались до нормальних показників. Така ж сама картина спостерігалась і з загально-клінічними показниками. Причиною таких змін в першу чергу можна вважати наявність синдрому ЕІ, який ускладнює перебіг післяопераційного періоду. За даними літератури, високий рівень ендогенної інтоксикації та наявність синдрому системної запальної відповіді негативно впливає на перебіг післяопераційного періоду при гнійно-запальних процесах за рахунок впливу на імунну систему, послаблюючи в першу чергу ланку гуморального імунітету, гальмуючи процеси репаративної регенерації та негативно впливає на роботу органів та систем, що приводить до прогресування гнійно-запального процесу та потребує проведення повторних оперативних втручань і може бути причиною смерті хворих з гнійно-запальними процесами [22, 23, 24, 25]. Отримані дані свідчать про те, що хворі, прооперовані з приводу парапроктиту в післяопераційному періоді потребують додаткового включення в схеми лікування засобів, які мали б політропну дію. Ми застосовували ректальні супозиторії «Далмаксін».
Порівнюючи отримані результати лікування гострого парапроктиту з використанням ректальних супозиторіїв «Далмаксін» у післяопераційному періоді виявлено, що перебіг післяопераційного періоду у цій групі хворих значно відрізнявся і мав більш сприятливий перебіг, про що свідчило більш швидке зниження ендогенної інтоксикації, зменшення мікробної забрудненості і очищення ран від некротичних тканин та більш швидка поява грануляцій, епітелізації та загоєння ран. Проведена оцінка використання супозиторіїв «Далмаксіну» у порівнянні зі стандартною терапією при комплексному лікуванні гострого гнійного парапроктиту показала, що включення препарату у схему лікування значно покращує перебіг післяопераційного періоду і тим самим сприяє скороченню термінів перебування хворих в стаціонарі.
Висновки
Застосування препаратів, що мають політропну дію доцільно у післяопераційному періоді. «Далмаксіну» в комплексному лікуванні гострого парапроктиту дозволило знизити рівень ендогенної інтоксикації, зменшити терміни перебування хворих в стаціонарі та прискорити загоєння ран за рахунок стимуляції процесів репаративної регенерації тканин.
Перспективи подальших досліджень
Отримані дані свідчать про доцільність подальшого вивчення препарату при лікуванні інших патологічних процесів в колопроктології.
ЛІТЕРАТУРА
- Isemberg G. A. Anorectal diseas / G.A. Isemberg G.A. // Clinics in Colon and Rectal surgery. — 2011.- 24(1) — P. 3 -4.Doi:10.55/s-0031 -1272817.
- Javier P.Gilbert Systematic rewiev with meta analisis: inflammatory bowel diseas in tht everly / Javier P.Gilbert //Alimentary Pharmacology and Tyerapeuticus.- 2014. -vol.39,issue 5 — P.459-477. https://doi.org / 10.1111./ apt.126616.
- Захараш М.П. Сучасні методи хірургічного лікування поєднаної патології анального каналу і прямої кишки / М. П. Захараш, В. В. Балицький, Е. Г. Курик // Шпитальна хірургія. Журнал імені Л.Я.Ковальчука. — 2017.- №4- с.89 — 94. Doi: 10.11603/2414 -4533.2017.48439.
- Демянов А. В. Острый парапроктит / А. В. Демянов, А. А. Андреев // Вестник экспериментальной и клинической хирургии. -2013. — Т.У1, № 4 — с.526 -534.
- Abcarian H. Anorectal Infection: Abscesses —Fistula / Abcarian H.//Clin.Colon Rectal Surg. -2011.-V.24, N 1 — p 14-21.
- Чарышкин А.Л. Результаты лечения больных острым парапроктитом / А. Л. Чарышкин, И.Н.Дементьев // Фундаментальные исследования. — 2013 — № 7-2. — С. 428-431.
- Тамм Т. I. Местное лечение послеоперационных ран у больных острым парапроктитом препаратом Дистрептаза /Т. И. Тамм, А. Б. Даценко, Е. Ю. Бабец, Е. Г. Даценко // Здоровье мужчины. -2012. — №3. — с.110-111.
- Мусин А. И. Особенности тактики лечения острого парапроктита / А. И. Мусин, И. В. Костарев // Анналы хирургии — 2017- т.22№2- с.81-87. Doi: http://dx.doi. org /10.18821/1560-9502-2017-22-2-81-87.
- Острый парапроктит лечебная тактика, хирургическое лечение / П. М. Лаврешин, В. К. Гоберджишвили, О. В. Владимирова, А. В. Жабина // Здоровье и образование в ХХ1 веке. -2017-т19, №11.- с.65-69. Dоі: http://dx.doi.org /10.26787/пуаіїа-2226-7425-2017-19-11.
- Абдулаев М. Ш. Острий парапроктит у больных сахарным диабетом /М. Ш. Абдулаев А. Б. Мансурова // Колопроктология. — 2012. — № 1. — С. 46-51.
- Власов А.П. Озонотерапия в комплексном лечении острого парапроктита /А. П. Власов, И. В. Кулыгина //Современные проблемы науки и образования. -2013. -№1. -с. 48-49.
- Белиничев И.Ф. Место тиотриазолина в галерее современных метаболитных препаратов /И. Ф. Белиничев, В. А. Визир, В. И. Мамчур, А. В. Курята // Запорожский медицинский журнал. -2019. -т.21, №1 (112)- с.118- 128.БОІ: 1014739/2310-1210.2019.1.155.855.
- Сімрок В.В. Місцеве застосування тіотриазоліну в комплексній терапії доброякісних процесів матки / В.В.Сімрок // Здоровье женщины.- 2013.- №1 (77) -с.165-167.
- Кондратенко П.Г. Хирургическая инфекция: практическое руководство / П.ГКондратенко, В.В.Соболев. -Донецк: Новий світ, 2007.-512 С.
- Теория и практика местного лечения гнойных ран [Безугла О.П., Белов С.Г., Гунько В.Г. и др.] / Под ред. Б.М.Даценко. — К.Здоров’я,1995. — 384С.
- Лабораторные методы исследования в клинике: Справочник / В. В. Меньшиков, Л.Н. Делекторская, Р.П. Золотницкая и др. / Под ред. В.В. Меньшикова. — М.: Медицина, 1987. — 386с.
- Медицинские лабораторные технологии / Под ред.. А.И.Карпищенко. — СПб.: Интермедиа, 2002. — 600с.
- Габриэлян Н.И. Опыт использования показателей средних молекул в крови для диагностики нефрологических заболеваний у детей /Н. И. Габриэлян, В. И. Менатов // Лабораторное дело. — 1984. — № 3. С. 138 — 140.
- Каль-Калиф Я. Я. О лейкоцитарном индексе интоксикации и его практическое значение/ Я.Я.Каль-Калиф // Врачебное дело. — 1941. — № 1. — С. 31 — 33.
- Васильев В. С. Критерии оценки тяжести болезни и выздоровления при скарлатине / В.С.Васильев, // Здравохранение Белоруссии. — 1993. -№ 2. — С. 38 — 40.
- Реброва О.Ю. Статистический анализ данных. Применение пакета прикладных программ 8ТАТІ8ТІСА: Монография / Реброва О.Ю. — М.: Медиа Сфера, 2003. — 312 с.
- Галкин А. А. Повреждение защитных функций нейтрофилов на ранней стадии ожоговой болезни /А.А.Галкин, В.С.Демидова // Успехи современной биологии -2012-т.132 ,№3 — С.297-311.
- Феофанов О.Д. Порушення функції нейтрофілів та стану ПОЛ в патогенезі гнійно-септичних захворювань у дітей / О.Д.Феофанов, Я.Д. Матяш, А.П.Юрцева, А.В.Теслюк //Галицький лікарський вісник.-2002.-т.9, №3.- С.300-301.
- Значение клеточного состава и цитокин продуцирующей активности клеток раневого отделяемого у больных с острыми одонтогенными воспалительными заболеваниями челюстно-лицевой области [Текст] /А.В.Лепилин, Н.Б. Захарова, Д.А. Федотенкова, Н.Е., Терешкина // Саратовский научно-медицинский журнал. — 2015. — № т.11, №2. — С. 173—177.
- Comparative Evaluation of C-Reactive Protein and WBC Count in Fascial Space Infections of Odontogenic Origin [Text] / R. Bagul, S. Chandan, V.D. Sane, S.Patil, D.Yaday // J. Maxillofac. Oral Surg. — 2017. — Vol. 16. — P. 238-242. Doi: 101007/s12663-016-0953-z22
- Антиоксиданты: Клинико-фармакологические аспекты /И.СЧекман, И.Ф.Белиничев, Н.А.Горчаков и др. //Український медичний часопис. -2014.-№1 — с.22-28.
- Отчет об экспериментальном изучении специфической (ранозаживляющей и гепатопротекторной) активности тиотриазолина /В.Р.Стец, С.М.Дороговоз, Т.Ф.Сарбаш и др. —Запорожье, 1990.-40с.
- Інструкція для медичного застосування лікарського препарату Далмаксін. Реєстраційне посвідчення UA/7595/01/01. Наказ МОЗ №1030 від 08.05.2019.
Share the post "ОБОСНОВАНИЕ ЭФФЕКТИВНОСТИ ПРИМЕНЕНИЯ РЕКТАЛЬНЫХ СУППОЗИТОРИЕВ «ДАЛМАКСИН» (ТИОТРИАЗОЛИН) В КОМПЛЕКСНОМ ЛЕЧЕНИИ ОСТРОГО ПАРАПРОКТИТА"

