С. И. Шпилевая, В. И. Тарутинов, В. С. Мосиенко, В.П. Рогацкая, И. О. Пономарев, Л.Н. Шинкаренко, В.Ф. Чехун
Институт экспериментальной патологии, онкологии и радиобиологии им. Р.Е. Кавецкого НАН Украины, Киев, Украина
Украинский НИИ онкологии и радиологии М3 Украины, Киев, Украина
Ключевые слова: рак молочной железы, поддерживающая терапия, пробиотический иммуномодулятор, стоимостъ поддерживающей терапии.
ОРИГИНАЛЬНЫЕ ИССЛЕДОВАНИЯ
КОРРЕКЦИЯ ЛЕЙКОПЕНИИ С ПОМОЩЬЮ НОВОГО ПРОБИОТИЧЕСКОГО ИММУНОМОДУЛЯТОРА (ПРОДУКТ LACTOBACILLUS DELBRUECKII) В КОМБИНИРОВАННОМ ЛЕЧЕНИИ БОЛЬНЫХ РАКОМ МОЛОЧНОЙ ЖЕЛЕЗЫ
Резюме. Проведено комбинированное лечение больных раком молочной железы (РМЖ) I—IV стадий в сочетании с пробиотическим иммуномодулятором — продуктом Lactobacillus Delbrueckii. Показано, что трех-, пятикратное подкожное введение этого иммуномодулятора в качестве препарата сопровождения эффективно препятствует развитию лейкопении на протяжении всего курса химио- и лучевой терапии. При лейкопении, развившейся в результате лечения больных РМЖ, введение препарата нормализует количество лейкоцитов, дает возможность завершить курс химио- и/или лучевой терапии. При этом одновременно со снижением побочного токсического действия противоопухолевых средств на организм повышается их эффективность, а также значительно снижается стоимость комбинированного лечения больных РМЖ.
ВВЕДЕНИЕ
При раке молочной железы (РМЖ) комплексное и комбинированное лечение проводят у 70,6—100% больных [1,2], при этом применение химиотерапевтических препаратов и/или использование облучения обусловлено прежде всего высоким уровнем первичной запущенности опухолевого процесса [3]. Повышение разовых и курсовых доз препаратов и лучевой терапии (ЛТ) [4] в целях улучшения результатов лечения приводит к развитию лейкопении в 31 — 100% случаев [5,6]. Возникающие на фоне лейкопении осложнения, обусловленные микробной и грибковой инфекцией, являются непосредственной причиной смерти онкологических больных [7,8].
В последнее десятилетие за рубежом поддерживающая (сопровождающая) терапия стала обязательным компонентом, получившим название «Peripheral blood stem cell support» (PBSCS), без которого проведение эффективного комбинированного и комплексного лечения больных с запущенными формами рака практически невозможно [9—11]. Для PBSCS-терапии рекомендуется использование препаратов крови, колониестимулирующих факторов (КСФ) [8, 11], вплоть до аутотрансплантации костного мозга [12].
Поддерживающая терапия в составе комбинированного или комплексного лечения требует больших затрат. Стоимость одного дня лечения онкологического больного в стационаре составляет от 1071 до 1892 долларов США [8, 12-15].
По данным некоторых авторов, стоимость PBSCS достигает 25,8% всех расходов, связанных с комбинированным лечением и пребыванием онкологического больного в стационаре [15]. При этом удельный вес стоимости противоопухолевых препаратов составляет только 18,5%, стоимость гранулоцитарных КСФ — 29,8%, препаратов крови — 35,8%, антибиотиков — 5,9%, противорвотных — 2,4%, других лекарственных средств — 7,6% [10].
Целью работы было определение эффективности применения нового пробиотического иммуномодулятора (продукта Lactobacillus Delbrueckii) при комбинированном лечении больных РМЖ. Актуальность данного исследования определяется необходимостью совершенствования поддерживающей терапии с учетом критерия «эффективность — стоимость».
ОБЪЕКТ И МЕТОДЫ ИССЛЕДОВАНИЯ
Проведено лечение 81 больной РМЖ І—IV стадий с использованием в послеоперационный период пробиотического иммуномодулятора (ПИ), ЛТ и/или различных комбинаций противоопухолевых химиопрепаратов (1-я группа) (табл. 1).
Таблица 1
Распределение больных 1-й группы в зависимости от метода специального лечения и стадии
| Метод специального лечения + ПИ | Стадия заболевания | |||
| I | II | III | IV | |
| ПХТ | 1 | 7 | 8 | 8 |
| ЛТ | 1 | 1 | 8 | 3 |
| ПХТ+ЛТ | 2 | 12 | 18 | 12 |
| Итого | 4 (4,9%) | 20 (24,7%) | 34 (42%) | 23 (28,4%) |
Средний возраст больных составил 50,2 ±1,1 года. ЛТ проведена дистанционным методом на установке «Агат В» с источником излучения 60Со в режиме дробного фракционирования по 2—2,5 Гр ежедневно на 2-4 поля. Средняя суммарная очаговая доза составила 39,24 ± 0,2 Гр, средняя продолжительность курса ЛТ — 19,6 ± 1,6 дня.
Полихимиотерапию (ПХТ) проводили по схемам СМ Г, АС, АР [16]. Средняя продолжительность курса ПХТ составила 12,8 ± 1,4 дня.
Во 2-ю (контрольную) группу методом исторической рандомизации включены 80 больных РМЖ, средний возраст которых составлял 49,9 ± 1.4 года (табл. 2).
Таблица 2
Распределение больных 2-й группы в зависимости от метода специального лечения и стадии РМЖ
| Метод специального лечения + ПИ | Стадия заболевания | |||
| I | II | III | IV | |
| ПХТ | 1 | 7 | 8 | 8 |
| ЛТ | 1 | 1 | 8 | 3 |
| ПХТ+ЛТ | 2 | 11 | 18 | 12 |
| Итого | 4 (5%) | 19(23,75%) | 34(42,5%) | 23 (28,75%) |
При комбинированном лечении больных 1-й группы в качестве поддерживающей терапии использован отечественный препарат Лиастен, новый ПИ, который представляет собой смесь структурных компонентов клеточных стенок и продуктов метаболизма Lactobacillus Delbrueckii (пептидогликаны, тейхоевые кислоты, нуклеотиды, пептиды) [17]. Препарат Лиастен в форме лиофилизированного порошка с наполнителем (НПЦ «Энзифарм», Украина) рекомендован ФК М3 Украины в 1997 г. для медицинского применения (Протокол № 1 от 30.01.97 г.). ПИ вводили в дозе 0,002 г больным подкожно в область наружной поверхности верхней трети плеча накануне начала специального лечения 1 раз в 3-7 дней (3-5 инъекций на курс). Непосредственно перед введением содержимое флакона растворяли в 2 мл изотонического раствора натрия хлорида. При использовании ПИ другие средства поддерживающей терапии не применяли. Эффективность ПИ у больных обеих групп при всех вариантах лечения оценивали по изменению количества лейкоцитов в периферической крови. Контроль количества лейкоцитов проводили за день до начала лечения, на 7—8-й день при ПХТ и на 10—11-й день при ЛТ (середина лечения), а также через 5-7 дней после окончания лечения.
При промышленном выпуске стоимость курса препарата, по нашим предварительным данным, будет на порядок меньше стоимости импортных препаратов (КСФ, препараты крови и т.д.) и составит по текущему курсу около 10 долларов США.
Статистическая обработка материала проведена методом определения средних, отношения их оценочных признаков, коэффициента корреляции и достоверности различий по t-критерию Стьюдента [18].
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
| Таблица 3 |
Количество лейкоцитов у больных 1-й и 2-й групп в процессе лечения приведено в табл. 3. До начала специального лечения количество лейкоцитов у больных 1-й группы было достоверно меньше, чем у больных 2-й группы. К середине лечения произошло выравнивание показателей у больных обеих групп при ХТ, ЛТ и ЛТ + ПХТ
| Метод лечения | Группа больных | Время исследования | ||
| до лечения | в середине лечения | после лечения | ||
| ПХТ | 1-я | 3.3 ±0,4 | 4,4 ±0,5 | 4,7 ±0,6 |
| 2-я | 4.6 ±0,3 | 3,5 ±0,2 | 3,3 ±0,2 | |
| Р1 | р < 0.02 | р > 0,05 | р < 0,05 | |
| ЛТ | 1-я | 3.0 ±0,3 | 3,7 ±0,4 | 3,8 ±0,6 |
| 2-я | 5,0 ±0,6 | 3,6 ±0,4 | 3,2 ±0,2 | |
| Р1 | р < 0,01 | р > 0,05 | р > 0,05 | |
| ПХТ + ЛТ | 1-я | 3,9 ±0,2 | 4,9 ±0,3 | 4,2 ±0,2 |
| 2-я | 6,0 ±0,7 | 4,7 ±0,4 | 3,1 ±0,2 | |
| Р1 | р < 0,01 | р > 0,05 | р< 0,001 | |
| При всех методах | 1-я | 3.7 ±0.2 | 4,7 ±0,2 | 4,3 ±0,2 |
| лечения | 2-я | 5,2 ±0,3 | 4,0 ±0,2 | 3,2 ±0,1 |
| P1 | р < 0,0001 | р < 0,02 | р < 0,00001 | |
| Количество лейкоцитов (*109/л) в периферической крови больных РМЖ при комбинированном или комплексном лечении (М ± m) |
| Примечание: 1-я — группа больных РМЖ с использованием в лечении ПИ; 2-я — контрольная группа больных РМЖ; р1 – различия статистически достоверны при р:< 0.05. |
(статистически значимых различий нет). В то же время у больных, получавших ПИ без учета метода специальной терапии, количество лейкоцитов статистически достоверно превысило таковое у больных, не получавших препарат (р < 0,02).
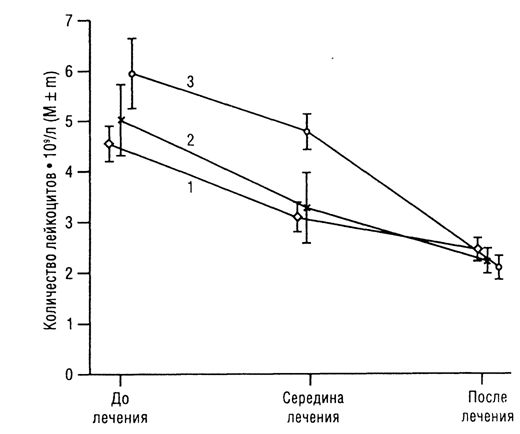
К концу лечения, по сравнению с началом, результат был прямо противоположным. Количество лейкоцитов у больных 1-й группы при всех вариантах лечения, за исключением ЛТ, было достоверно больше, чем у больных 2-й группы (р<0,05–р <0,00001). У больных 1-й и 2-й групп, получавших ЛТ, между показателями количества лейкоцитов к концу лечения статистически значимых различий не обнаружено. Приведенные данные показывают, что изменение показателей количества лейкоцитов у больных обеих групп имеет различный характер (рис. 1).
Уменьшение количества лейкоцитов у больных 2-й группы и их увеличение у больных 1 -й группы в процессе лечения во второй четверти лечения формируют «ножницы», и в дальнейшем вплоть до середины лечения эта динамика имеет прямо противоположный характер. По окончании лечения количество лейкоцитов уменьшается у больных 2-й группы и увеличивается у больных 1 -й группы, что свидетельствует о лейкостимулирующей функции ПИ при кумуляции цитотоксического эффекта специального лечения.
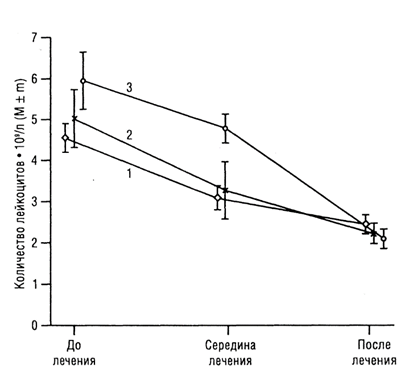
При всех вариантах лечения у больных 1-й группы (рис. 2) сохраняется стойкая положительная динамика количества лейкоцитов. Коэффициент корреляции за период «до лечения – середина лечения» – r = 0,973 (р < 0,05), за период «до лечения — после окончания лечения» — г = 0,266 (р >0,1).
Рис. 1. Изменение среднего количества лейкоцитов в периферической крови у больных 1-й и 2-й групп при лечении: 1 — с ПИ; 2 — без ПИ.
Рис. 2. Изменение среднего количества лейкоцитов в периферической крови при различных видах специального лечения у больных РМЖ в сочетании с ПИ: 1 — ПХТ; 2 — ЛТ; 3 — ПХТ + ЛТ
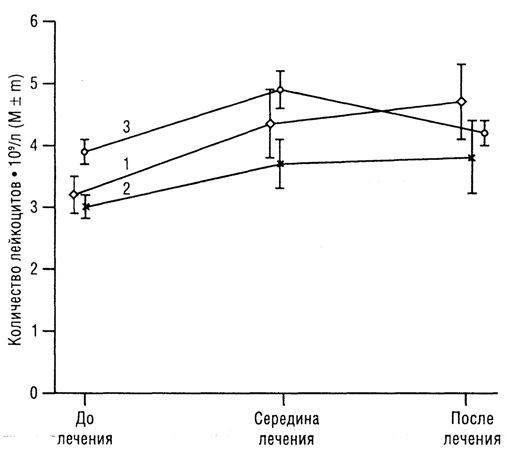
Рис. 3. Изменение среднего количества лейкоцитов в периферической крови при различных видах специального лечения у больных РМЖ без использования ПИ: 1 — ПХТ; 2 — ЛТ: 3 — ПХТ + ЛТ
У больных 2-й группы (рис. 3) в процессе лечения отмечено уменьшение количества лейкоцитов.
За период «до лечения — середина лечения» коэффициент корреляции составил r = 0,997 (р < 0,001), а за период «до лечения —после окончания лечения» — r = -0,866 (р > 0,1), то есть при противоположной динамике количества лейкоцитов в обеих группах к середине лечения показатели в 1-й группе статистически достоверно повышаются, а во 2-й – статистически достоверно снижаются. За весь период лечения динамика показателей в 1-й группе положительная, а во 2-й – отрицательная, что свидетельствует о «лавинообразном» уменьшении количества лейкоцитов у больных 2-й группы при проведении различных видов специального лечения. При этом лейкостимулирующий эффект ПИ при всех методах специального лечения превышал влияние цитотоксического действия противоопухолевых средств, что выражается в сохранении положительного значения коэффициента корреляции даже при уменьшении количества лейкоцитов во второй половине лечения.
Особо следует отметить обратную корреляционную зависимость показателей количества лейкоцитов у больных обеих групп к середине лечения. В этот период r составил -0,797 (р < 0,01), то есть если во 2-й группе цитотоксический эффект подтверждается уменьшением количества лейкоцитов, то на фоне ПИ происходит их увеличение.
Это необходимо учитывать при планировании специального лечения, когда возникает необходимость увеличения лучевой или химиотерапевтической нагрузки в первой половине лечения.
Применение ПИ при всех методах специального лечения к окончанию лечения способствует увеличению количества лейкоцитов по сравнению с исходными показателями. Это свидетельствует о том, что протекторное действие ПИ превышает цитотоксическое действие ЛТ и ПХТ. В случаях специального лечения без использования ПИ количество лейкоцитов к окончанию лечения достоверно меньше исходных значений.
Осложнений, связанных с применением препарата, не отмечено.
Лейкостимулирующая функция ПИ сочетается с его экономической доступностью. Средняя стоимость химиопрепаратов для курса лечения РМЖ составила 115 долларов США на 1 больного, а стоимость данного препарата — 10% от общих затрат, расходуемых больными на один курс лечения. По данным литературы, удельный вес стоимости поддерживающей терапии в общих затратах на медикаменты составляет более 70% [10].
ВЫВОДЫ
Таким образом, использование ПИ в качестве поддерживающей терапии при специальном лечении больных РМЖ эффективно защищает лейкопоэз в течение всего курса химио- и/или лучевой терапии. Применение препарата в комбинированном лечении больных РМЖ достоверно повышает количество лейкоцитов к окончанию курса специального лечения по сравнению с исходно сниженными данными.
Использование ПИ значительно удешевляет проведение комбинированного лечения больных РМЖ, снижает побочные токсические воздействия противоопухолевых средств на лейкопоэз и дает возможность завершить курс лечения химио- и/или лучевой терапии в полном объеме.
ЛИТЕРАТУРА
- Тарутінов BI, Досенко IB, Шпильова СІ. Принципи формування індивідуальних планів етапного лікування хворих на рак молочної залози з урахуванням основних патогенетичних форм захворювання (методичні рекомендації). Київ, 1999. 24 с.
- Fernando IN, Powles TJ, Dowsett M, et al. Determining factors which predict response to primary medical therapy in breast cancer using a single fine needle aspirate with immunocytochemical staining and flow cytometry. Virchows Arch 1995; 426:155—61.
- Hortobagyi GN, Buzdar AU, Strom EA, et al. Primary chemotherapy for early and advanced breast cancer. Cancer Lett 1995; 90: 103-9.
- Crown J, Coiffier B, Cortes-Funes H, et al. ESTIC position paper: High-dose chemotherapy for breast cancer, investigation should continue. Ann Oncol 1999; 10: 903—7.
- Международный опыт использования фарморубицина (эпирубицина) для лечения больных раком молочной железы. Онкология 1999; (3): 233—7.
- Calais G, Descamps Р, Chapet S, et al. Primary chemotherapy and radiosurgerical breast-conserving treatment for patients with locally advanced operable breast cancer. Int J Radiat Oncol Biol Phys 1993; 26: 37—42.
- Montero MC, Valdivia ML, Carvajal E, et al. Economic study of neutropenia induced by myelotoxic chemotherapy. Pharm World Sci 1994: 16: 187-92.
- Lyman GH, Kuderer N, Greene J, Balducci L. The economics of febrile neutropenia: implications for the use of colony-stimulating factors. EurJ Cancer 1998; 34: 1857—64.
- Hewitt AA. Cancer and neutropenia database study. Can J Oncol 1994;4:277-84.
- Kath R, Hartmann M, Hoflken K. Pharmacoeconomic evaluation of high-dose chemotherapy and peripheral blood stem cell support in high-risk or poor-prognosis malignancies. J Cancer Res Clin Oncol 1998; 124:288-90.
- Koumakis G, Vassilomanolakis M , Barbounis V, et al. Optimal timing (Preemptive versus supportive) of granulocyte colony-stimulating factor administration following high-dose cyclophosphamide. Oncology 1999; 56: 28—35.
- Souetre E, Qing W, Penelaud PF. Economic analysis of the use of recombinant human granulocyte colony-stimulating factor in autologous bone marrow transplantation. EurJ Cancer 1996; 32: 1162-5.
- Lyman GH, Lyman CG, Sanderson RA, Balducci L. Decision analysis of hematopoietic growth factor use in patients receiving cancer chemotherapy. J Natl Cancer Inst 1993; 85: 488-93.
- Nichols CR, Fox EP, Roth В J, et al. Incidence of neutropenic fever in patients treated with standard-dose combination chemotherapy for small-cell lung cancer and the cost impact of treatment with granulocyte colony-stimulating factor. J Clin Oncol 1994; 12:1245—50.
- Leese B, Collin R, Clark DJ. The costs of treating febrile neutropenia in patients with malignant blood disorders. Pharmacoeconomics 1994; 6:233—9.
- Гарин AM, Хлебников AB. Справочник практической химиотерапии опухолей. Москва: Росмэн, 1995. 309 с.
- Мосієнко ВС, Мосієнко МД, Савцова ЗД та ін. Ліастен – новий вітчизняний імуномодулятор біологічного походження. Журн АМНУ 1999; 5: 79—85. Каминский ЛС. Обработка клинических и лабораторных данных. Ленинград: Медицина, 1959. 196 с.
CORRECTION OF LEUKOPENIA BY NEW
PROBIOTIC IMMUNOMODULATOR
(LACTOBACILLUS DELBRUECKII
PRODUCT) IN COMBINED TREATMENT
OF BREAST CANCER
S.I. Shpilevaya, V.I. Tarutinov, V.S. Mosienko, V.P. Rogatsкaya, I. O. Ponomarev, L.N. Shynkarenko, V.F. Chekhun
Summary. The authors carry out the combined treatment of breast cancer patients (stages I—IV) using the new immunomodulating agent, product of Lactobacillus Delbrueckii. The triple hypodermic injection of this immunomodulator, as a drug of supporting therapy, during three weeks, has been shown to protect effectively from leukopoiesis supression, during the complete period of the chemo-and radiotherapy. Moreover, employing this new drug enables us also to normalize white blood parameters in patients with leukopenia arising in the course of the treatment preventing interruption of treatment schedule. New probiotic immunomodulator turned out to reduce the toxic side effects of cytotoxic drugs with the concomitant increase of their efficacy. At the same time the cost of the combined treatment of breast cancer patients could be reduced.
KeyWords: breast cancer, maintenance therapy, probiotic immunomodulator, cost of a maintenance therapy.
Share the post "Коррекция лейкопении с помощью нового пробиотического иммуномодулятора (продукт lactobacillus delbrueckii) в комбинированном лечении больных раком молочной железы"