ОРИГІНАЛЬНІ ДОСЛІДЖЕННЯ
КОРЕКЦІЯ ЛЕЙКОПЕНІЇ ЗА ДОПОМОГОЮ НОВОГО ПРОБІОТИЧНОГО ІМУНОМОДУЛЯТОРА (ПРОДУКТ LACTOBACILLUS DELBRUECKII) У КОМБІНОВАНОМУ ЛІКУВАННІ ХВОРИХ НА РАК МОЛОЧНОЇ ЗАЛОЗИ
С. І. Шпильова, В. І. Тарутинов, В. С. Мосієнко, В.П. Рогацька, І. О. Пономарьов, Л.М. Шинкаренко, В.Ф. Чехун.
Інститут експериментальної патології, онкології та радіобіології ім. Р.Є. Кавецького НАН України, Київ, Україна.
Український НДІ онкології та радіології М3 України, Київ, Україна.
Ключові слова: рак молочної залози, підтримуюча терапія, пробіотичний імуномодулятор, вартість підтримуючої терапії.
Резюме. Проведено комбіноване лікування хворих на рак молочної залози (РМЗ) І—ІV стадій у поєднанні з пробіотичним імуномодулятором — продуктом Lactobacillus Delbrueckii. Показано, що три-, п’ятикратне підшкірне введення цього імуномодулятора у якості препарата супроводу, ефективно перешкоджає розвитку лейкопенії упродовж всього курсу хіміо- та променевої терапії. У разі лейкопенії, котра розвинулася внаслідок лікування хворих на РМЗ, введення препарата нормалізує кількість лейкоцитів, дає можливість завершити курс хіміо- та/або променевої терапії. При цьому, водночас зі зниженням побічної токсичної дії протипухлинних засобів на організм, підвищується їхня ефективність, а також значно знижується вартість комбінованого лікування хворих на РМЗ.
ВВІДНА ЧАСТИНА
При діагнозі раку молочної залози (РМЗ), комплексне та комбіноване лікування проводять у 70,6-100% хворих [1,2], при цьому застосування хіміотерапевтичних препаратів та/або використання опромінення, обумовлено насамперед високим рівнем первинної занедбаності пухлинного процесу [3]. Підвищення разових та курсових доз препаратів і променевої терапії (ПТ) [4] з метою поліпшення результатів лікування, призводить до розвитку лейкопенії у 31 – 100% випадків [5,6]. Ускладнення, котрі виникають на тлі лейкопенії, зумовлені мікробною та грибковою інфекцією, стають безпосередньою причиною смерті онкологічних хворих [7,8].
Останнім десятиріччям, за кордоном, підтримуюча (супроводжувальна) терапія стала обов’язковим компонентом, котрий назвали «Peripheral blood stem cell support» (PBSCS), і без якого, проведення ефективного комбінованого та комплексного лікування хворих із запущеними формами раку, практично неможливе [9-11]. Для PBSCS-терапії рекомендується застосування препаратів крові, колонієстимулюючих чинників (КСЧ) [8, 11], аж до аутотрансплантації кісткового мозку [12].
Підтримуюча терапія у складі комбінованого або комплексного лікування потребує великих витрат. Вартість одного дня лікування онкологічного хворого у стаціонарі складає від 1071 до 1892 доларів США [8, 12-15].
За даними деяких авторів, вартість PBSCS сягає 25,8% усіх витрат, пов’язаних із комбінованим лікуванням та перебуванням онкологічного хворого у стаціонарі [15]. При цьому питома вага вартості протипухлинних препаратів становить лише 18,5%, вартість гранулоцитарних КСЧ – 29,8%, препаратів крові – 35,8%, антибіотиків – 5,9%, протиблювотних – 2,4%, інших лікарських засобів – 7,6% [10].
Метою роботи було визначення ефективності застосування нового пробіотичного імуномодулятора (продукту Lactobacillus Delbrueckii) у складі комбінованого лікування хворих на РМЗ. Актуальність цього дослідження визначається необхідністю вдосконалення підтримуючої терапії з урахуванням критерію «ефективність – вартість».
ОБ’ЄКТ І МЕТОДИ ДОСЛІДЖЕННЯ
Проведено лікування 81 хворій на РМЗ І—IV стадій з використанням у післяопераційному періоді пробіотичного імуномодулятора (ПІ), ПТ та/або різних комбінацій протипухлинних хіміопрепаратів (1-я група) (табл. 1).
Таблиця 1
Розподіл хворих 1-ї групи у відповідності до метода спеціального лікування та стадії
| Метод спеціального лікування + ПІ | Стадія захворювання | |||
| I | II | III | IV | |
| ПХТ | 1 | 7 | 8 | 8 |
| ПТ | 1 | 1 | 8 | 3 |
| ПХТ+ПТ | 2 | 12 | 18 | 12 |
| Загалом | 4 (4,9%) | 20 (24,7%) | 34 (42%) | 23 (28,4%) |
Середній вік хворих склав 50,2±1,1 року. ПТ проведена дистанційним методом на установці «Агат В» з джерелом випромінювання 60Co в режимі дробового фракціювання по 2-2,5 Гр щодня на 2-4 поля. Середня сумарна вогнищева доза склала 39,24±0,2 Гр, середня тривалість курсу ПТ – 19,6±1,6 дня.
Поліхіміотерапію (ПХТ) проводили за схемами СМ Г, АС, АР [16]. Середня тривалість курсу ПХТ складала 12,8±1,4 дня.
До 2-ї (контрольної) групи, методом історичної рандомізації включено 80 хворих на РМЗ, середній вік котрих становив 49,9 ± 1.4 роки (табл. 2).
Таблиця 2
Розподіл хворих 2-ї групи в залежності від методу спеціального лікування та стадії РМЗ
| Метод спеціального
лікування + ПІ |
Стадія захворювання | |||
| I | II | III | IV | |
| ПХТ | 1 | 7 | 8 | 8 |
| ПТ | 1 | 1 | 8 | 3 |
| ПХТ+ПТ | 2 | 11 | 18 | 12 |
| Загалом | 4 (5%) | 19 (23,75%) | 34 (42,5%) | 23 (28,75%) |
У складі комбінованого лікування хворих 1-ї групи, у якості підтримуючої терапії використано вітчизняний препарат Ліастен (стара назва «Бластен»), новий ПІ, котрий є сумішшю структурних компонентів клітинних стінок і продуктів метаболізму Lactobacillus Delbrueckii (пептидоглікани, тейхоєві кислоти, нуклеотиди, пептиди) [17]. Препарат Ліастен (стара назва «Бластен») у формі ліофілізованого порошку з наповнювачем (НВЦ «Ензіфарм», Україна) рекомендовано ФК М3 України у 1997 р. для медичного застосування (Протокол №1 від 30.01.97 р.). Пробіотичний імуномодулятор (ПІ) вводили хворим в дозі 0,002 г підшкірно у ділянку зовнішньої поверхні верхньої третини плеча напередодні початку спеціального лікування 1 раз на 3-7 днів (3-5 ін’єкцій на курс). Безпосередньо перед введенням, вміст флакона розчиняли у 2 мл ізотонічного розчину натрію хлориду. У разі застосування ПІ, інших засобів підтримуючої терапії не використовували. Ефективність ПІ у хворих обох груп за всіх варіантів лікування оцінювали за зміною кількості лейкоцитів у периферичній крові. Контроль кількості лейкоцитів проводили за день до початку лікування, на 7-8 день застосування ПХТ та на 10-11 день застосування ПТ (середина лікування), а також через 5-7 днів після закінчення лікування.
Статистичну обробку матеріалів проведено методом визначення середніх, відношення їх оціночних ознак, коефіцієнта кореляції та достовірності відмінностей за t-критерієм Стьюдента [18].
РЕЗУЛЬТАТИ ТА ЇХ ОБГОВОРЕННЯ
Кількість лейкоцитів у хворих 1-ї та 2-ї груп під час лікування наведено в табл. 3. До початку спеціального лікування, кількість лейкоцитів у хворих 1-ї групи була достовірно меншою, ніж у хворих 2-ї групи. До середини лікування відбулося вирівнювання показників у хворих обох груп при використанні ХТ, ПТ та ПТ+ПХТ
Таблиця 3
| Метод лікування | Група хворих | Етап дослідження | ||
| до лікування | в середині лікування | після лікування | ||
| ПХТ | 1-а | 3.3 ±0,4 | 4,4 ±0,5 | 4,7 ±0,6 |
| 2-а | 4.6 ±0,3 | 3,5 ±0,2 | 3,3 ±0,2 | |
| Р1 | р < 0.02 | р > 0,05 | р < 0,05 | |
| ПТ | 1-а | 3.0 ±0,3 | 3,7 ±0,4 | 3,8 ±0,6 |
| 2-а | 5,0 ±0,6 | 3,6 ±0,4 | 3,2 ±0,2 | |
| Р1 | р < 0,01 | р > 0,05 | р > 0,05 | |
| ПХТ + ПТ | 1-а | 3,9 ±0,2 | 4,9 ±0,3 | 4,2 ±0,2 |
| 2-а | 6,0 ±0,7 | 4,7 ±0,4 | 3,1 ±0,2 | |
| Р1 | р < 0,01 | р > 0,05 | р< 0,001 | |
| За всіх методів лікування | 1-а | 3.7 ±0.2 | 4,7 ±0,2 | 4,3 ±0,2 |
| 2-а | 5,2 ±0,3 | 4,0 ±0,2 | 3,2 ±0,1 | |
| P1 | р < 0,0001 | р < 0,02 | р < 0,00001 | |
| Кількість лейкоцитів (*109/л) у периферичній крові хворих на РМЗ при комбінованому або комплексному лікуванні (М ± m) |
Примітка: 1-а група хворих на РМЗ із використанням у лікуванні ПІ; 2-а – контрольна група хворих на РМЗ; р1 – відмінності статистично достовірні при р: <0.05 (статистично значущі відмінності відсутні). У той же час, у хворих, котрі отримували ПІ без урахування методу спеціальної терапії, кількість лейкоцитів статистично достовірно перевищила таку у хворих, котрі препарат не отримували (р<0,02).
Наприкінці лікування, у порівнянні з початком, результат був прямо протилежним. Кількість лейкоцитів у хворих 1-ї групи при всіх варіантах лікування, за винятком ПТ, була достовірно більшою, ніж у хворих 2-ї групи (р<0,05-р<0,00001). У хворих 1-ї та 2-ї груп, котрі отримували ПТ, між показниками кількості лейкоцитів наприкінці лікування статистично значущих відмінностей не виявлено. Наведені дані свідчать, що зміна показників кількості лейкоцитів у хворих обох груп має різний характер (мал. 1).
Зменшення кількості лейкоцитів у хворих 2-ї групи та їх збільшення у хворих 1-ї групи під час лікування у другій чверті лікування, утворюють «ножиці», і надалі аж до середини лікування, ця динаміка має протилежний характер. Після закінчення лікування, кількість лейкоцитів зменшується у хворих 2-ї групи та збільшується у хворих 1-ї групи, що свідчить про лейкостимулювальну функцію ПІ на тлі кумуляції цитотоксичного ефекту спеціального лікування.
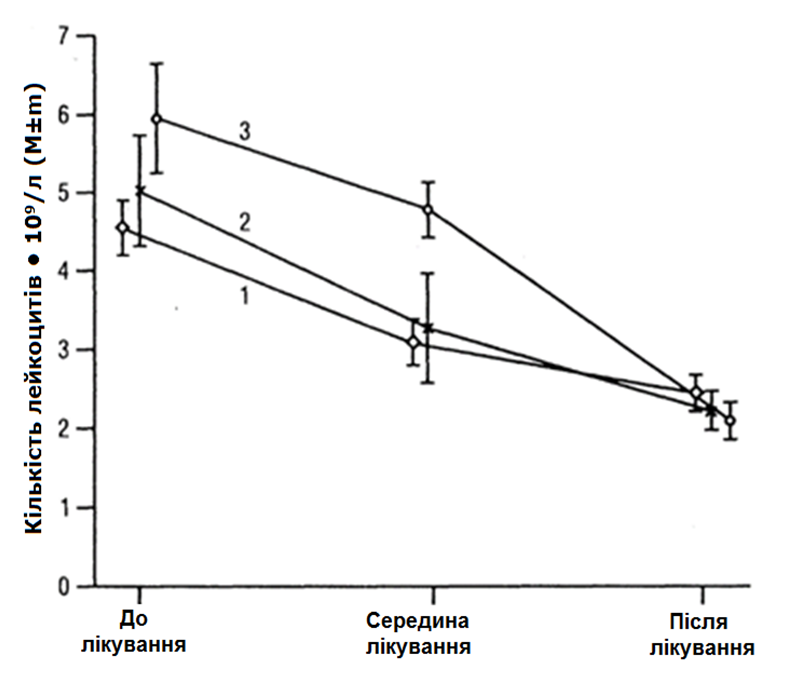
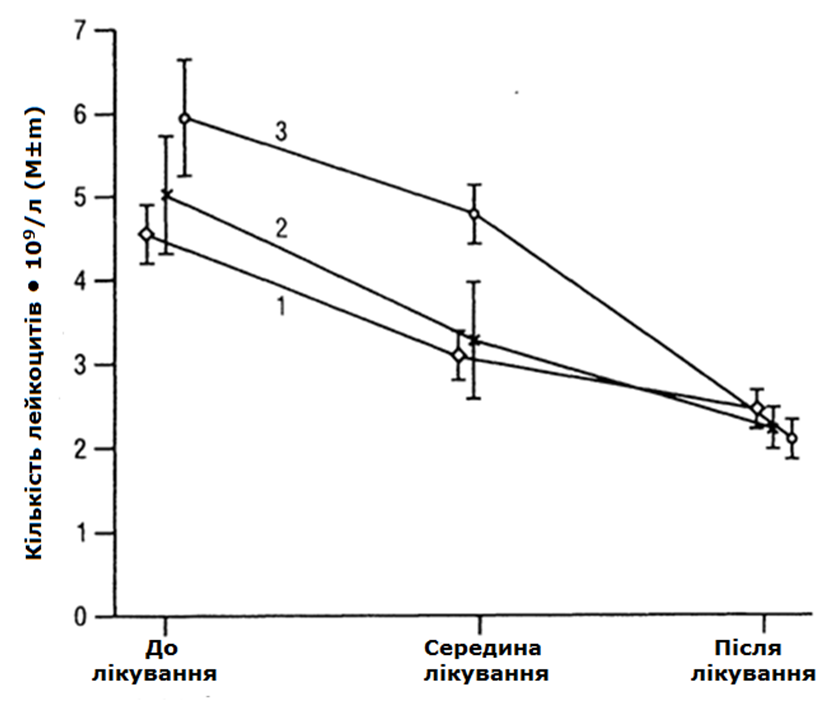
За всіх варіантів лікування, у хворих 1-ї групи (мал. 2) зберігається стійка позитивна динаміка кількості лейкоцитів. Коефіцієнт кореляції за період «до лікування – середина лікування» – r = 0,973 (р < 0,05), за період «до лікування – після закінчення лікування» – r = 0,266 (р > 0,1).
Мал. 1. Зміна середньої кількості лейкоцитів в периферичній крові у хворих 1-ї та 2-ї груп при лікуванні: 1 – з ПІ; 2 – без ПІ.
Мал. 2. Зміна середньої кількості лейкоцитів у периферичній крові за різних видів спеціального лікування у хворих на РМЗ у поєднанні з ПІ: 1 — ПХТ; 2 – ПТ; 3 – ПХТ + ПТ
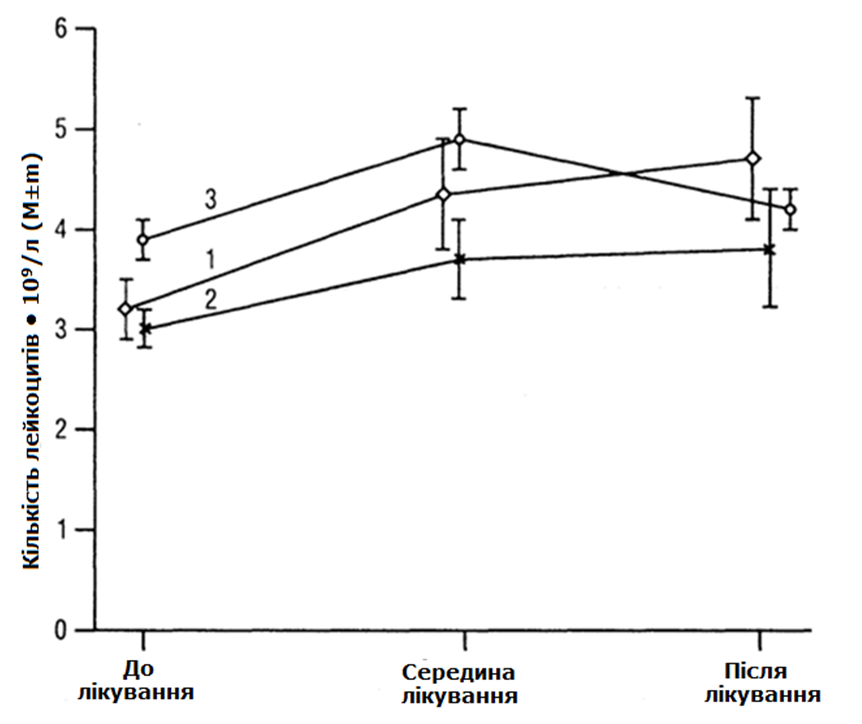
Мал. 3. Зміна середньої кількості лейкоцитів у периферичній крові за різних видів спеціального лікування у хворих на РМЗ без використання ПІ: 1 — ПХТ; 2 – ПТ: 3 – ПХТ + ПТ
У хворих 2-ї групи (мал. 3) під час лікування відмічено зменшення кількості лейкоцитів.
За період «до лікування – середина лікування», коефіцієнт кореляції склав r = 0,997 (р < 0,001), а за період «до лікування – після закінчення лікування» – r = -0,866 (р > 0,1), тобто за наявності протилежної динаміки щодо кількості лейкоцитів в обох групах до середини лікування, показники у 1-й групі статистично достовірно підвищуються, а у 2-й – статистично достовірно знижуються. За весь період лікування, динаміка показників у 1-й групі позитивна, а у хворих 2-ї – негативна, що свідчить про «лавиноподібне» зменшення кількості лейкоцитів у хворих 2-ї групи за проведення різних видів спеціального лікування. При цьому лейкостимулювальний ефект ПІ за всіх методів спеціального лікування переважав над впливом цитотоксичної дії протипухлинних засобів, що виражається у збереженні позитивного значення коефіцієнта кореляції навіть на тлі зменшення кількості лейкоцитів у другій половині лікування.
Треба особливо наголосити на зворотній кореляційній залежності показників кількості лейкоцитів у хворих обох груп до середини лікування. У цей період r становить -0,797 (р < 0,01), тобто якщо у 2-й групі цитотоксичний ефект підтверджується зменшенням кількості лейкоцитів, то на тлі ПІ відбувається їх збільшення.
Це необхідно враховувати у плануванні спеціального лікування, коли виникає необхідність збільшення променевого чи хіміотерапевтичного навантаження у першій половині лікування.
Застосування ПІ за всіх методів спеціального лікування до закінчення лікування, сприяє збільшенню кількості лейкоцитів у порівняні з вихідними показниками. Це свідчить про те, що протекторна дія ПІ перевищує цитотоксичний вплив ПТ та ПХТ. У випадках проведення спеціального лікування без застосування ПІ, кількість лейкоцитів до закінчення лікування є достовірно меншою від вихідних значень.
Ускладнень, що були б пов’язані із застосуванням препарата, не відмічалося.
Лейкостимулювальна функція ПІ поєднується з його економічною доступністю. Середня вартість хіміопрепаратів для курсу лікування РМЗ становила 115 доларів США на 1 хворого, а вартість цього препарата – 10% від загальних видатків, що витрачаються хворими на один курс лікування. За даними літератури, питома вага вартості підтримуючої терапії у загальних видатках на медикаменти складає понад 70% [10].
Висновки
Таким чином, використання пробіотичного імуномодулятора (ПІ) у якості підтримуючої терапії під час спеціального лікування хворих на РМЗ, ефективно захищає лейкопоез упродовж всього курсу хіміо- та/або променевої терапії. Застосування препарата у комбінованому лікуванні хворих на РМЗ достовірно підвищує кількість лейкоцитів до закінчення курсу спеціального лікування у порівнянні з вихідно зниженими даними.
Використання ПІ значно здешевлює проведення комбінованого лікування хворих на РМЗ, зменшує побічні токсичні впливи протипухлинних засобів на лейкопоез і дає можливість завершити курс лікування хіміо- та/або променевої терапії в повному обсязі.
ЛІТЕРАТУРА
- Тарутінов BI, Досенко IB, Шпильова СІ. Принципи формування індивідуальних планів етапного лікування хворих на рак молочної залози з урахуванням основних патогенетичних форм захворювання (методичні рекомендації). Київ, 1999. 24 с.
- Fernando IN, Powles TJ, Dowsett M, et al. Determining factors which predict response to primary medical therapy in breast cancer using a single fine needle aspirate with immunocytochemical staining and flow cytometry. Virchows Arch 1995; 426:155—61.
- Hortobagyi GN, Buzdar AU, Strom EA, et al. Primary chemotherapy for early and advanced breast cancer. Cancer Lett 1995; 90: 103-9.
- Crown J, Coiffier B, Cortes-Funes H, et al. ESTIC position paper: High-dose chemotherapy for breast cancer, investigation should continue. Ann Oncol 1999; 10: 903—7.
- Международный опыт использования фарморубицина (эпирубицина) для лечения больных раком молочной железы. Онкология 1999; (3): 233—7.
- Calais G, Descamps Р, Chapet S, et al. Primary chemotherapy and radiosurgerical breast-conserving treatment for patients with locally advanced operable breast cancer. Int J Radiat Oncol Biol Phys 1993; 26: 37—42.
- Montero MC, Valdivia ML, Carvajal E, et al. Economic study of neutropenia induced by myelotoxic chemotherapy. Pharm World Sci 1994: 16: 187-92.
- Lyman GH, Kuderer N, Greene J, Balducci L. The economics of febrile neutropenia: implications for the use of colony-stimulating factors. EurJ Cancer 1998; 34: 1857—64.
- Hewitt AA. Cancer and neutropenia database study. Can J Oncol 1994;4:277-84.
- Kath R, Hartmann M, Hoflken K. Pharmacoeconomic evaluation of high-dose chemotherapy and peripheral blood stem cell support in high-risk or poor-prognosis malignancies. J Cancer Res Clin Oncol 1998; 124:288-90.
- Koumakis G, Vassilomanolakis M , Barbounis V, et al. Optimal timing (Preemptive versus supportive) of granulocyte colony-stimulating factor administration following high-dose cyclophosphamide. Oncology 1999; 56: 28—35.
- Souetre E, Qing W, Penelaud PF. Economic analysis of the use of recombinant human granulocyte colony-stimulating factor in autologous bone marrow transplantation. EurJ Cancer 1996; 32: 1162-5.
- Lyman GH, Lyman CG, Sanderson RA, Balducci L. Decision analysis of hematopoietic growth factor use in patients receiving cancer chemotherapy. J Natl Cancer Inst 1993; 85: 488-93.
- Nichols CR, Fox EP, Roth В J, et al. Incidence of neutropenic fever in patients treated with standard-dose combination chemotherapy for small-cell lung cancer and the cost impact of treatment with granulocyte colony-stimulating factor. J Clin Oncol 1994; 12:1245—50.
- Leese B, Collin R, Clark DJ. The costs of treating febrile neutropenia in patients with malignant blood disorders. Pharmacoeconomics 1994; 6:233—9.
- Гарин AM, Хлебников AB. Справочник практической химиотерапии опухолей. Москва: Росмэн, 1995. 309 с.
- Мосієнко ВС, Мосієнко МД, Савцова ЗД та ін. Бластен – новий вітчизняний імуномодулятор біологічного походження. Журн АМНУ 1999; 5: 79—85. Каминский ЛС. Обработка клинических и лабораторных данных. Ленинград: Медицина, 1959. 196 с.
CORRECTION OF LEUKOPENIA BY NEW PROBIOTIC IMMUNOMODULATOR (LACTOBACILLUS DELBRUECKII PRODUCT) IN COMBINED TREATMENT OF BREAST CANCER
S.I. Shpilevaya, V.I. Tarutinov, V.S. Mosienko, V.P. Rogatsкaya, I. O. Ponomarev, L.N. Shynkarenko, V.F. Chekhun
Summary. The authors carry out the combined treatment of breast cancer patients (stages I—IV) using the new immunomodulating agent, product of Lactobacillus Delbrueckii. The triple hypodermic injection of this immunomodulator, as a drug of supporting therapy, during three weeks, has been shown to protect effectively from leukopoiesis supression, during the complete period of the chemo-and radiotherapy. Moreover, employing this new drug enables us also to normalize white blood parameters in patients with leukopenia arising in the course of the treatment preventing interruption of treatment schedule. New probiotic immunomodulator turned out to reduce the toxic side effects of cytotoxic drugs with the concomitant increase of their efficacy. At the same time the cost of the combined treatment of breast cancer patients could be reduced.
Key Words: breast cancer, maintenance therapy, probiotic immunomodulator, cost of a maintenance therapy.
Share the post "КОРЕКЦІЯ ЛЕЙКОПЕНІЇ ЗА ДОПОМОГОЮ НОВОГО ПРОБІОТИЧНОГО ІМУНОМОДУЛЯТОРА (ПРОДУКТ LACTOBACILLUS DELBRUECKII) У КОМБІНОВАНОМУ ЛІКУВАННІ ХВОРИХ НА РАК МОЛОЧНОЇ ЗАЛОЗИ"