УДК 616. 419-092. 9:615 [. 277. 3:. 357:. 37]
ЗАЩИТА КОСТНОГО МОЗГА МЫШЕЙ ОТ ЦИКЛОФОСФАМИД-ИНДУЦИРОВАННОЙ ЦИТОСУПРЕССИИ ПРЕБИОТИЧЕСКИМ ИМУНОМОДУЛЯТОРОМ ЛИАСТЕНОМ И НЕЙРОГОРМОНОМ МЕЛАТОНИНОМ
М. Д. Мосиенко*, Л.С. Линив, С. С. Киреева, В. М. Рябуха, В.С. Мосиенко
Институт экспериментальной патологии, онкологии и радиобиологии им. Р.Е. Кавецкого НАН Украины, Киев, Украина
THE PROTECTION OF MICE BONE MARROW FROM CYCLOPHOSPHAMIDE-INDUCED CYTOTOXITY BY PREBIOTIC IMMUNOMODULATOR BLASTEN AND NEUROHORMONE MELATONIN
M.D. Mosienko, L.S. Lyniv, S.S.Kirieieva, W.M. Ryabukha, W.S. Mosienko
R.E.Kavetsky Institute of Experimental Pathology, Oncology and Radiobiology, National Academy of Sciences of Ukraine, 03022,Kyiv,Ukraine
Тел./факс: 263-94-16, 266-98-27
Использованные сокращения:
ЦФ — циклофосфан,
ПИБ — пребиотический иммуномодулятор Лиастен (старое название Лиастен)
Исследовано влияние иммуномодулятора Лиастена (старое название Лиастен) и нейрогормона мелатонина на защиту костного мозга мышей от цитосупрессии, индуцированной циклофосфаном. После многократных курсов циклофосфана в терапевтических дозах, у нелинейных мышей отмечено постепенное снижение уровня дифференциации клеток всех веток кроветворения, накопление в костном мозге низкодифференцированных клеточных элементов, падение уровня лейкоцитов (особенно лимфоцитов) и эритроцитов в периферической крови. При совместном применении с циклофосфаном иммуномодулятора Лиастена или гормона мелатонина, выявлен эффект защиты костного мозга от цитотоксического действия циклофосфана – существенное повышение уровня зрелых клеток лимфоидного ряда, постепенное восстановление дифференциации незрелых форм гранулоцитов и увеличение уровня лимфоцитов, что характерно для нормального костного мозга. Отмечено существенно меньшее падение в периферической крови уровня лейкоцитов и эритроцитов, в сравнении с действием одного лишь ЦФ.
Ключевые слова: циклофосфан, иммуномодулятор Лиастен, нейрогормон мелатонин, костный мозг, периферическая кровь.
The capacity of immunomodulator blasten and neurohormone melatonin to protect bone marrow from cyclophosphamide-induced cytotoxity was investigated. The gradual reduction in all haemopoietic cell differentiation, accumulation of low differentiated cells in bone marrow, decrease of leucocyte and erythrocyte levels in peripheral blood were observed after repeated cyclophosphamide treatment in therapeutical doses on nonbred mice. Effect of bone marrow protection from cytotoxic affect of cyclophosphamide was detected under simultaneous injection with immunomodulator blasten or with hormone melatonin. Significant increase in high differentiated lymphoid cells, gradual renewal of low differentiated granulocytes, and increase in lymphocyte level till norm for mice bone marrow. It is much less fall of lymphocyte and erythrocyte levels were detected in peripheral blood in comparison with affect of cyclophosphamide alone.
Key Words: cyclophosphamide, immunomodulator blasten, neurohormone melatonin, bone marrow, peripheral blood.
В современной клинической онкологии, достаточно актуальной остается проблема токсичности противоопухолевой терапии, которой присущ широкий спектр поражения жизненно важных органов и систем организма, среди которых наиболее чувствительны: костный мозг, лимфоидные органы, эпителий желудочно-кишечного тракта. Это приводит к ухудшению адаптивно-компенсаторных механизмов и является серьезным препятствием для дальнейшего продолжения курсов химиотерапии и достижения положительных результатов при лечении больных со злокачественными опухолями [1,2]. Несмотря на то, что система крови обладает значительными компенсаторными возможностями, они существенно ограничиваются при длительных воздействиях на организм цитосупрессивной терапии [3-5]. Это делает целесообразным разработку новых подходов и экспериментально обоснованных концепций защиты иммуно- и гемопоэза в динамике повторных курсов химиотерапии онкологических больных.
Наряду с использованием специфических средств, стимулирующих кроветворение и имеющих побочные эффекты, все больше внимания уделяется естественным препаратам, с более физиологическими возможностями коррекции гемо- и иммунопоэза. Среди перспективных в этом отношении препаратов, особое место занимает новый оригинальный отечественный пребиотический иммуномодулятор Лиастен, полученный из клеточных стенок молочнокислых бактерий штамма Lactobacillus Delbrueckii [6]. Экспериментальные исследования показали, что Лиастен в малых дозах проявляет иммунокорригирующую активность в отношении широкого спектра реакций гуморального и клеточного иммунитета, обладает некоторым противоопухолевым и антиметастатическим действием, улучшает микроциркуляцию крови [7].
Следует отметить, что, в отличие от других препаратов этой группы, Лиастен практически не токсичен. В доклинических экспериментах была выявлена его способность защищать гемо- и иммунопоэз, способствовать восстановлению клеток кишечного эпителия после химиотерапии ЦФ, эффективно уменьшать радиационно-индуцированную цитосупрессию, усиливать противоопухолевый эффект ЦФ и биотерапии плацентарными факторами, продлевать жизнь облученных животных [8—11].
Клиническими исследованиями установлена способность Лиастена защищать лейкопоэз, повышать уровень ИЛ-1 и ИЛ-2, и, что особенно важно, повышать общую 5-летнюю и безрецидивную выживаемость больных раком молочной железы при неоадъювантном комплексном лечении [12]. Но, несмотря на накопленный опыт применения Лиастена, нерешенными остаются вопросы его влияния на костный мозг и периферическую кровь, особенно после многократных курсов химиотерапии. В данном аспекте внимание исследователей привлекает и гормон эпифиза – мелатонин [13].
Исследование гормона мелатонина в качестве средства защиты костного мозга обусловлено его природными иммуномодулирующими свойствами, способностью стабилизировать геном клетки на фоне действия генотоксических факторов, угнетать пролиферацию в злокачественных опухолях, а согласно последним данным, мелатонин рассматривают также как естественную антиангиогенную молекулу в организме [14—16]. Продемонстрировано его прямое онкостатическое действие через механизм контроля экспрессии онкогенов, индукции апоптоза в трансформированных клетках, ингибирования свободных радикалов и иммуномодулирующая активность за счет высвобождения ИЛ-2, ИЛ-4, ИЛ-6 [17-24]. Применение мелатонина в фармакологических дозах, также может оказаться перспективным при лечении злокачественных новообразований с целью профилактики возникновения мутаций в нормальных клетках и вторичных опухолей вследствие воздействия на организм облучения и противоопухолевых препаратов [25-27].
С этих позиций, целью было изучить в эксперименте возможность защиты костного мозга и периферической крови с помощью иммуномодулятора Лиастена и пинеального гормона мелатонина при повторных курсах введения циклофосфана у интактных мышей.
Методика исследований
Эксперименты проводились на 60 интактных нелинейных мышах-самцах возрастом 2,5-3 месяца, массой 23-25 г, разведения вивария ИЭПОР им. Р.Е. Кавецкого НАН Украины. Материалом исследования были костный мозг эпифиза бедренной кости и периферическая кровь.
Химиопрепарат циклофосфан (Украина, ОАО Киевмедпрепарат) вводили подкожно, в дозе 150 мг/кг на курс, три раза, с интервалом 10-12 суток. Иммуномодулятор Лиастен (Украина, г. Ладыжин, ВТО «Энзим») вводили в дозе 1/1000 (7 мг/кг массы тела) и 1/75000 (0,09 мг/кг массы тела) от ЛД50 (7000 мг/кг), подкожно, за сутки перед инъекцией ЦФ. Гормон мелатонин (США, Sigma), использовали в дозе 5 мг/кг, подкожно, по одной инъекции ежедневно в течение 10 суток после курсового введения ЦФ, и 3 инъекции после завершения последнего курса ЦФ (за 3 курса химиотерапии – всего 23 инъекции), в 17 часов.
Мышей разделили на следующие группы: 1-я — контрольная, введение физиологического раствора, 8 животных; 2-я – введение одного лишь ЦФ, 14 животных; 3-я – введение Лиастена в дозе 1/1000 от ЛД50 + ЦФ, 14 животных; 4-я – введение Лиастена в дозе 1/75000 от ЛД50 + ЦФ, 14 животных; 5-я — ЦФ+мелатонин, 10 животных.
Учитывая данные литературы о том, что наибольшее угнетение костного мозга и периферической крови отмечается на 3-5 сутки после введения циклофосфана, в эти сроки декапитацией забивали по 4-5 животных из каждой группы, у которых стандартными методиками исследовались миелограммы костного мозга (окрашивание по Паппенгейму), мазки периферической крови (окрашивание по Романовскому-Гимза), общепринятым методом в камере Горяева определяли абсолютное количество лейкоцитов и эритроцитов периферической крови.
Результаты экспериментов статистически обработаны с использованием t-критерия Стьюдента [28].
Результаты исследований и их обсуждение
При введении в терапевтической дозе одного лишь ЦФ, в миелограммах мышей отмечено постепенное снижение уровня дифференциации клеток всех веток кроветворения (Табл.1), что приводит к накоплению в костном мозге низкодифференцированных клеточных элементов, а в мазках периферической крови проявляется падением уровня лимфоцитов (Табл. 2).
Таблица 1. Клеточный состав (%) костного мозга нелинейных мышей в динамике курсового введения циклофосфана.
| Клеточные элементы | Группы мышей | ||||||||||
| 1 | 2 | 3 | 4 | 5 | |||||||
І курс ЦФ |
|||||||||||
| Промиелоциты | 2,5±0,42 | 3,0±0,67 | 2,6±1,2 | 2,9±0,47 | 3,1±0,61 | ||||||
| Миелоциты | 7,1±,35 | 6,8±2,0 | 7,0±1,67 | 7,9±1,61 | 8,0±0,36 | ||||||
| Метамиелоциты | 13±1,21 | 10,6±2,21 | 10,1 ±1,47 | 12,6±1,49 | 14±0,51 | ||||||
|
Палочкоядерные лейкоциты |
18,6±2,21 | 19,8±1,0 | 18,5±1,21 | 17,1±1,35 | 19,1±1,47 | ||||||
|
Сегментоядерные лейкоциты |
22,6±1,33 | 20,8±2,0 | 20,5±1,21 | 21,6±1,33 | 20,1±2,47 | ||||||
| Моноциты | 3,0±0,36 | 3,8±1,0 | 3,4±1,71 | 3,1±1,61 | 3,8±0,47 | ||||||
| Лимфоциты | 13,3±1,21 | 13,0±1,51 | 13,5±2,67 | 12,6±1,21 | 13,1±2,47 | ||||||
| Эритробласты | 0,6±0,21 | 1,0±0 | 1,3±0,21 | 0,5±0,22 | 0,66±0,21 | ||||||
|
Полихроматофильные нормоциты |
9,6±0,21 | 10,1±1,61 | 10,5±1Л | 10,1±1,47 | 11,6±1,49 | ||||||
ІІ курс ЦФ |
|||||||||||
| Промиелоциты | 2,5±1,42 | 4,1±0,б1 | 4,0±0,67 | 4,3±0,21 | 3,0±0,67 | ||||||
| Миелоциты | 7,0±1,67 | 8,6±1,49 | 8,3±1,21 | 8,5±1,67 | 7,0±1,б7 | ||||||
| Метамиелоциты | 12,6±0,49 | 19,5±0,22 | 17,6±1,49 | 16,0±0,57 | 13,8±0,47 | ||||||
|
Палочкоядерные лейкоциты |
18,5±1,21 | 19,5±1,21 | 18,6±2,71 | 19,5±2,67 | 17.8±2,47 | ||||||
|
Сегментоядерные лейкоциты |
19,3±2,21 | 23,3±2,21 | 26,6±1,21 | 24,6±2,23 | 25,5±1,22 | ||||||
| Моноциты | 3,5±0,42 | 4,1±0,47 | 3,6±0,71 | 3,5±1,67 | 4,5±0,67 | ||||||
| Лимфоциты | 11,6±1,71 | 9,6±1,21 | 14,8±1,71 | 13,0±0,57 | 12,6±0,49 | ||||||
| Эритробласты | 0,5±0,22 | 1,6±0,49 | 1,3±0,21 | 2,0±0 | 3,3±0,21 | ||||||
|
Полихроматофильные нормоциты |
9,6±0,21 | 4,6±0,21 | 5,0±0,57 | 5,6±1,21 | 7,5±3,6 | ||||||
ІІІ курс ЦФ |
|||||||||||
| Промиелоциты | 3,0±0,67 | 4,6±0,71 | 4,0±0,67 | 4,0±0,67 | 3,0±0,67 | ||||||
| Миелоциты | 7,9±1,67 | 8,5±1,67 | 8,5±1,67 | 7,0±1,67 | 8,0±0,33 | ||||||
| Метамиелоциты | 12,64=1,21 | 21,1±1,61 | 19,6±1,49 | 20,5±1,21 | 14,0±2,б7 | ||||||
|
Палочкоядерные лейкоциты |
19,8±2,0 | 22,1±2,61 | 19,5±1,67 | 18,5±1,67 | 19,6±171 | ||||||
|
Сегментоядерные лейкоциты |
21,3±2,21 | 19,6±2,71 | 23,6±1,21 | 22,3±2,67 | 26,5±1,22 | ||||||
| Моноциты | 2,6±0,49 | 4,0±0,67 | 4,5±0,67 | 4,3±0,21 | 4,6±0,71 | ||||||
| Лимфоциты | 13,6±2,33 | 10,1±1,47 | 21,3±1,88 | 19,3±2,88 | 20,6±2,33 | ||||||
| Эритробласты | 0,3±0,21 | 2,0±0 | 2,0±0 | 2,3±0,21 | 0,6±0,71 | ||||||
|
Полихроматофильные нормоциты |
7,9±1,67 | 5,0±0,57 | 4,9±1,67 | 4,5±3,6 | 6,0±0,57 | ||||||
Костный мозг приобретал промиелоцитарно-миелоцитарный характер. Так, если после 1-й инъекции уровень метамиелоцитов составлял 10,6±2,2%, то после 2-й поднимался до 19,5±0,2% (45%), а после 3-й — равнялся 21,1±1,6% (50%).
Количество миелоцитов составляло 6,8±2,0%, 8,6±1,5% и 8,5±1,7% после 1-й, 2-й и 3 -й инъекций ЦФ, соответственно. С каждым последующим введением ЦФ отмечается прогрессирование лейкопении. Уровни палочкоядерных и сегментоядерных нейтрофилов после 2-й инъекции составляли 19,5±1,2% и 23,3±2,2%, что было выше, чем в контрольной группе (18,5±1,2% и 19,3±2,2% соответственно). Такой уровень зрелых нейтрофильных лейкоцитов свидетельствует об активации защитных механизмов костного мозга. О нарушении созревания свидетельствует и токсическая грануляция нейтрофилов, их гиперсегментация, увеличение размеров ядер и клеток.
В периферической крови наблюдались дегенеративные изменения: пикноз, хроматинолиз, гиперсегментация нейтрофилов, вакуолизация. Отмечена токсическая грануляция лейкоцитов нейтрофильного ряда, увеличение размеров как ядер, так и самих клеток. В мазках периферической крови отмечалось повышение процентного соотношения гранулоцитарных лейкоцитов, возможно, обусловленное поступлением клеток из костного мозга. Эти сдвиги в костном мозге происходят за счет угнетения процессов пролиферации, и торможения формирования и созревания кровяных элементов из полипотентных клеток предшественников – стволовых клеток.
Таблица 2. Динамика некоторых показателей (%) лейкоцитарной формулы периферической крови нелинейных мышей в процессе многократных курсов химиотерапии ЦФ.
|
Показатель, группы мышей |
Курсы химиотерапии ЦФ |
||
|
1-й |
2-й |
3-й |
|
|
Сегментоядерные нейтрофилы |
|||
|
1. Интактный контроль |
18,6 ± 2,21 |
16,6 ± 2,71 |
19,1 ± 1,66 |
|
2. ЦФ |
20,3 ± 2,66 |
28,6 ± 3,66 |
24,6 ± 3,66 |
|
3. ПИБ (7 мг/кг) + ЦФ |
9,3 ± 1,66 |
25,5 ± 2,22 |
21,6 ± 2,21 |
|
4. ПИБ (0,09 мг/кг)+ЦФ |
6,8 ± 1,79 |
22,6 ± 2,21 |
22,3 ± 2,66 |
|
5. ЦФ+ мелатонин |
19,1 ± 2,47 |
16,6 ± 1,71 |
23,8 ± 1,79 |
|
Лимфоциты |
|||
|
1. Интактный контроль |
70,6 ± 3,49 |
72,6 ± 4,67 |
73,6 ± 3,4 |
|
2. ЦФ |
66,8 ± 3,79 |
60,5 ± 3,21 |
62,5 ± 3,21 |
|
3. ПИБ (7 мг/кг) + ЦФ |
70,1 ± 4,35 |
66,6 ± 3,66 |
71,1 ± 4,35 |
|
4. ПИБ (0,09 мг/кг)+ЦФ |
74,3 ± 3,66 |
63,6 ± 2,7 |
70,3 ± 3,66 |
|
5. ЦФ+ мелатонин |
72,4 ± 2,71 |
64,6 ± 2,33 |
69,6 ± 3,66 |
|
Моноциты |
|||
|
1. Интактный контроль |
9,1 ± 1,61 |
8,6 ± 1,71 |
8,6 ± 0,33 |
|
2. ЦФ |
8,6 ± 1,33 |
7,6 ± 1,33 |
6,6 ± 1,71 |
|
3. ПИБ (7 мг/кг) + ЦФ |
7,6 ± 1,33 |
6,6 ± 1,71 |
7,3 ± 1,66 |
|
4. ПИБ (0,09 мг/кг)+ЦФ |
6,6 ± 1,33 |
6,6 ± 0,49 |
7,6 ± 1,33 |
|
5. ЦФ+ мелатонин |
8,6 ± 0,33 |
6,6 ± 0,49 |
8,6 ± 0,33 |
Количество лимфоцитов было сниженным как в костном мозге, так и в периферической крови (7,2±1,2% и 8,1±1,5% и 47,5±3,2% (65%), и 51,5±3,2% (69%) соответственно, после 2-й и после 3-й инъекции) в сравнении с контролем (соответственно 72,6±4,6% и 73,6±3,4%). Среди лимфоцитов были клетки с вакуолизацией и изорванными краями. Таким образом, выявленные количественные и качественные изменения в клетках лимфоцитарного ряда свидетельствуют о цитотоксическом действии ЦФ на костный мозг.
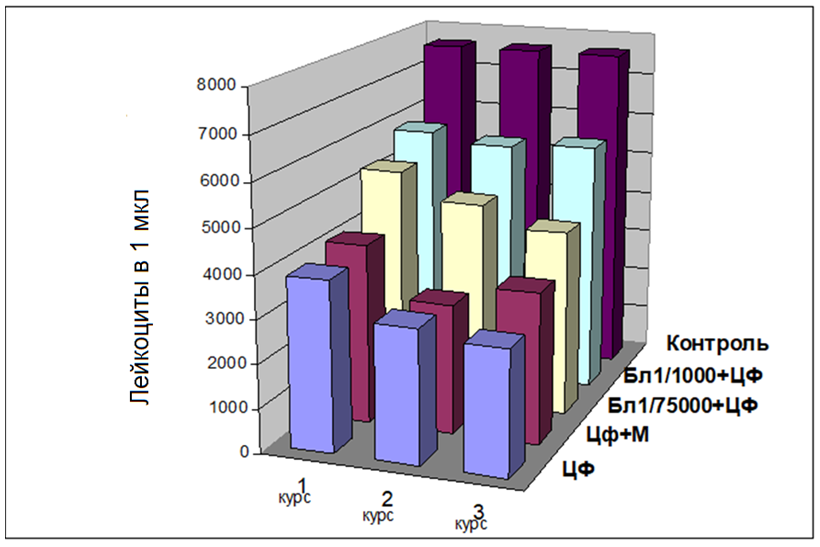
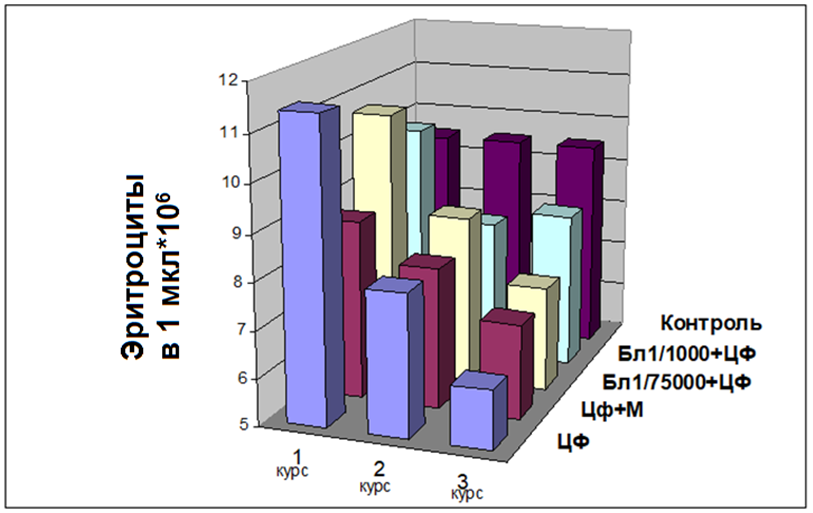
Кроме того, отмечены незначительные (Р<0,05) колебания уровня моноцитов в костном мозге и периферической крови, что также свидетельствует о реакции на цитотоксическое действие препарата. При морфологическом исследовании периферической крови в динамике трех курсов химиотерапии, это проявляется постепенным снижением количества лейкоцитов соответственно на 48,9%, 60,0% и 62,6%, кратковременным повышением количества эритроцитов на 11,9% после первого введения ЦФ, и последующим постепенным снижением этого показателя на 16,1% после второго, и на 34,3% после третьего курса ЦФ (рис. 1).
Рис. 1. Динамика уровня лейкоцитов в периферической крови нелинейных мышей при действии циклофосфана и в сочетании его с Лиастеном или мелатонином.
При цитологическом анализе миелограмм костного мозга, в случае применения иммуномодулятора Лиастена, обнаружено, что он, несмотря на влияние цитостатика, уже на 3 сутки после его введения существенно поддерживает лимфоидный ряд кроветворения. Если в случаях применения одного лишь ЦФ количество лимфоцитов в костном мозге было ниже, чем в контрольной группе, то там, где применялся Лиастен, уровень лимфоцитов превышал норму. При этом при использовании Лиастена в дозе 1/1000 от ЛД50, уровень лимфоцитов составлял 13,5±2,6% (1-я гр.), 14,8±1,7% (2-я гр.) и даже 21,3 ±1,9% (3-я гр.). Однако наблюдались единичные клетки с бахромчатой цитоплазмой и вакуолизацией.
При использовании Лиастена в 1/75000 от ЛД50, уровень лимфоцитов равнялся 12,6±1,2%, 13,0±0,6% и даже 19,3±2,9% (соответственно 1-я, 2-я и 3-я инъекция) (табл.1.). То есть, более эффективной оказалась доза Лиастена 1/1000 от ЛД50. Более того, отмечена стимуляция дифференциации гранулоцитарной ветки кроветворения. Если при действии только лишь ЦФ, ядра некоторых миелоцитов и промиелоцитов были фрагментированы, то в случаях применения Лиастена с ЦФ, качественные изменения наблюдались только в зрелых нейтрофильных лейкоцитах, которые значительно увеличивались в размерах. В сравнении с цитостатиком, не наблюдалась фрагментация ядер с отщеплением ядерной субстанции и формирование отдельно лежащих образований, в меньшей степени была выражена токсичная зернистость.
Так, высокодифференцированных клеток нейтрофильного ряда – сегментоядерных лейкоцитов, после 2-го курса ЦФ насчитывалось 26,6±1,21% и 24,6±2,33% соответственно, при большей и малой дозе Лиастена, в то время как при действии только самого ЦФ – 23,3±2,21%. После 2-го и 3-го курсов химиотерапии ЦФ с Лиастеном выявлено меньшее количество метамиелоцитов (менее дифференцированных клеток-предшественников нейтрофильных лейкоцитов) – 18,5±1,21% и 17,1±1,35% и 19,5±1,67% и 20,5±1,61%, соответственно дозе Лиастена (1/1000 и 1/75000 от ЛД50) в сравнении с 19,5±1,21% и 21,1±1,61% при действии самого лишь ЦФ. Однако не отмечено влияние Лиастена на эритроидный ряд. Так, количество эритробластов составляло 2,0±0% и 2,3±0,2%, в зависимости от дозы, в сравнении с 2,0±0% при использовании одного только ЦФ. В то же время, в контрольной группе у интактных мышей насчитывалось 0,3±0,21% этих клеток. А полихроматофильных нормоцитов оказалось 4,9±1,67 и 4,5±3,6 (1 и 2 дозы Лиастена) в сравнении с 5,0±0,56 при использовании только ЦФ. Уровень погибших клеток был значительно ниже.
Таким образом, выявлено, что введение иммуномодулятора Лиастена в сутки до инъекции ЦФ, приводит к стимуляции дифференциации гранулоцитарных лейкоцитов и к увеличению уровня клеток лимфоидного ряда. Процесс регенерации был обусловлен активной пролиферацией юных гемопоэтических элементов, который смещался в сторону ускорения процессов созревания и выброса зрелых клеток в периферическую кровь. В периферической крови, восстановление гемопоэтической ткани происходит с участием глубинных резервов кроветворения: переходных гемогистоидных элементов, которые дифференцируются в сторону миелоидной ветви.
Трансформацией гемогистобластов в нейтрофилы, минуя ряды промежуточных стадий и наличием сокращенных путей дифференциации, можно объяснить такую быструю гемопоэтическую функцию, учитывая также известное иммуномодулирующее свойство препарата. Однако не отмечено влияния Лиастена на эритроидную ветвь кроветворения. В то же время выявлена четкая положительная динамика восстановления нарушений морфологического состава показателей периферической крови после длительного действия цитостатика. Несмотря на то, что каждый последующий курс введения ЦФ усиливал лейкопению, ее уровень был существенно (Р<0,05) ниже в случаях превентивного введения Лиастена. Так, количество лейкоцитов после трех курсов ЦФ снизилось только на 24,4 % при использовании Лиастена в дозе 1/1000 и на 44,1 % — при дозе Лиастена 1/75000, в сравнении с 62,6 % при действии самого только ЦФ, а количество эритроцитов — на 12,2%, 23,8% и 34,3% соответственно (рис. 2).
Рис. 2. Динамика содержания эритроцитов в периферической крови нелинейных мышей при действии циклофосфана и в сочетании его с лиастеном или мелатонином.
При совместном введении ЦФ и мелатонина, в цитограммах костного мозга выявлено постепенное восстановление дифференциации незрелых форм гранулоцитов и увеличение уровня лимфоцитов, а в мазках периферической крови – повышение уровня лейкоцитов до их показателей в контрольной группе животных (Табл.1, 2). Так, в костном мозге из нейтрофильных гранулоцитов — метамиелоцитов насчитывалось 14±0,5%, 13,8±0,5% и 14,02,7% (1-я, 2-я и 3-я инъекции соответственно). Высокодифференцированных клеток – сегментоядерных лейкоцитов, отмечено 20,1±2,5%, 25,5±1,2% и 26,5±1,2% соответственно.
Уровень лимфоцитов составлял 20,6±2,3% после 3-й инъекции, в то время как при использовании только самого ЦФ – 10,1±1,5%. Из данных литературы и наших предыдущих исследований известно, что мелатонин ингибирует полипотентную стволовую клетку и стимулирует более зрелые клетки к дифференциации, стимулируя лимфоциты к выделению интерлейкинов, которые в свою очередь влияют на выделение клетками стромы гранулоцит-макрофаг колониеформирующих единиц [ 9-13]. Приведенное выше свидетельствует о том, что мелатонин в фармакологических дозах существенно корригирует индуцированные ЦФ цитотоксические изменения в лимфоцитарном и эритроидном рядах кроветворения.
Однако, в динамике трех курсов химиотерапии ЦФ с использованием мелатонина, не было обнаружено существенных отличий в морфологическом составе периферической крови по сравнению с использованием самого только ЦФ. Возможно, это связано с ранними сроками определения исследуемых показателей, поскольку согласно данным литературы, при других схемах, такой эффект был продемонстрирован. В наших опытах, после третьего курса химиотерапии уже начала проявляться положительная динамика восстановления показателей белой и красной крови, что подтверждает данные литературы о пролонгированном эффекте мелатонина.
Таким образом, многократное курсовое введение ЦФ приводит к развитию лейкопении, лимфоцитопении, снижению количества лимфоцитов и эритроцитов в периферической крови нелинейных мышей. Превентивное введение иммуномодулятора Лиастена или терапевтическое введение гормона мелатонина в ходе курса химиотерапии ЦФ способствует защите костного мозга и периферической крови от цитосупрессивного действия цитостатика. При этом лучшую эффективность показала доза Лиастена 1/1000 от ЛД50 (7 мг/кг). Данные литературы свидетельствуют, что по другой схеме его применения, низкие дозы Лиастена (0,07-0,09 мг/кг) более эффективно корректировали негативное влияние однокурсового введения ЦФ на гемо- и иммунопоэз [8]. Отсюда, использование пребиотического иммуномодулятора Лиастена и нейрогормона мелатонина позволяет уменьшить побочные эффекты химиотерапии, а именно – ее цитосупрессивное действие на костный мозг, периферическую кровь, и тем самым дает возможность продлить запланированные курсы лечения онкологических больных.
Сравнительный анализ эффектов защиты костного мозга от цитотоксического действия циклофосфана иммуномодулятором Лиастеном и гормоном мелатонином показал, что Лиастен существенно увеличивает количество клеток гранулоцитарного ряда на разных стадиях их дифференциации. В свою очередь, индольный гормон мелатонин стимулирует дифференциацию клеток-предшественников как миелопоэза, лимфопоэза, так и эритропоэза.
ЛИТЕРАТУРА
- Мосиенко ВС. Возможности, недостатки и перспективы лекарственной терапии опухолевой болезни. Українськ хіміотерапевт журн 2000, 1: 10—14.
- Montero MC, Valdivia ML, Carvajal E. Economic study of neutropenia induced by mieloxic chemotherapy. Pharm World Sci 1994; 16: 187—192.
- Гольдберг ДИ, Дедова ЛС. Действие массивных доз циклофосфана на кроветворение в эксперименте. Вопр онкол 1969, 15(4): 82—7.
- Пінчук ЛБ, Родіонова НК. Зміни в системі кістковомозкового кровотворення у тварин, які постійно утримувались у Чорнобильській зоні відчуження. В: Чорнобиль. Зона відчуження. Збірник праць Київ Наук. Думка, 2001; 429—435.
- Гольдберг ДИ, Патент 20509, А61К 35/74, С 12 1/20. Біотехнологічний спосіб одержання імуномодулюючого препарату. Болоховська ВА, Волкова МЮ, Воспяков ВГ, Даниленко ВС, Латишевська ГВ, Мартинюк НБ, Мосієнко ВС, Мосієнко МД, Савцова ЗД, Сойченко ВВ, Шинкаренко ЛМ, Щеглова НА. — АТНБЦ «Ензифарм», UA. — № 95083935; заявл.28.08.95.; публ. 15.07.97.
- Мосієнко ВС, Мосієнко МД, Савцова ЗД, Даниленко ВС, Волкова МЮ, Шинкаренко ЛМ, Щеглова НА, Восп’яков ВГ, Свідро ОВ, Меньок ТА. Лиастен — новий вітчизняний імуномодулятор біологічного походження. Журн АМН України 1999; 5(1): 79—86.
- Менек ТА, Воейкова ИМ, Юдина ОЮ, Мосиенко ВС, Шинкаренко ЛН, Савцова ЗД. Влияние иммуномодулятора из Lactobacillus Delbrueckii на терапевтическую эффективность циклофосфамида у мышей с карциномой Льюис. Эксп Онкол 2000, 22(4): 211—14.
- Мосиенко ВС, Савцова ЗД, Менек ТА, Мосиенко МД, Касьяненко ИВ, Шинкаренко ЛН. Эффективность иммуномодулятора Лиастен в профилактике и лечении лучевой и химической цитосупрессии. Імунол та алергол 1999, (3): 54.
- Савцова ЗД, Меньок ТА, Джаман НШ, Воєйкова ІМ, Ковбасюк СА, Мосієнко ВС. Дозозалежність впливу імуномодулятора мікробного походження на дискретні показники крові та лімфоїдних органів опромінених тварин. Наук записки НаУКМА біол та екологія 2000, 18: 25—30.
- Мосієнко МД, Рябуха ВМ, Пясковська ОМ, Мосієнко ВС, Вінницький ВБ. Протипухлинна активність превентивної імунізації мишей С57Вl/6 з карциномою Льюїс плацентарними факторами та імуномодулятором пребіотичного походження Лиастеном. Эксп онкол 2001, 4: 278—81.
- Тарутинов ВИ, Мосиенко ВС, Касьяненко ИВ, Шпилевая СИ, Рогацкая ВП, Хруленко ЛТ, Пономарев ИО, Гулак ЛО, Мосиенко МД, Пивнюк ВМ, Шинкаренко ЛН, Воспяков ВГ, Чехун ВФ. Выживаемость больных раком молочной железы при комплексном лечении с использованием природного иммуномодулятора из Lactobacillus Delbrueckii. Укр хіміотерапевт журн 2001; 2(10): 51—56.
- Brzezinski А. Mechanisms of disease: melatonin in humans.The New Eng J Medicine 1997: 336(3).
- Vanecek J. Mechanisms of melatonin action. Physiol Res 1998, 40(1): 11—
- Blask DE. Melatonin in oncology. In: Melatonin. Biosynthesis, physiological effects and clinical applications.H.-S. R.J. Reiter eds. CRC Press, Boca Raton, 1993; 447-475.
- Lissoni P, Rovelli F, Malugani F, Maestroni GJM. Anti-angiogenic activity of melatonin in advanced cancer patients. Neuroend. Letters 2001: 22, 45—47.
- Линів ЛС, Кірєєва СС, Шишко ЕД, Вінницький ВБ. Гормон епіфізу мелатонін. Біологічні функції, механізми дії та перспективи застосування. Вісник проблем біолог і медиц 2000; 4: 5—15.
- KoratkarR, VasudhaA, RameshG, Padma M, Das UN. Effects of melatonin on cis-platinum-induced genetic damage to the bone marrow cells of mice.Med.Sci.Res. — 1992:(20).
- Reiter R, Tang Lei. Garcia JJ, Munoz-Hoyos A. Pharmacological actions of melatonin in oxygen radical pathophysiology. Life Sci 1997, 60: 2255—
- Lissoni P, Barni. S, Cataneo E, Ardizzoia A, Tancini G, Maestroni GJM. Pineal-interleukin-2 interaction and their possible importance in the pathogenesis of immune dysfuntions in cancer. In Role of melatonin and pineal peptides in neuroimmunomodulation . Fraschini E, Reiter RE. New York: Plenum Press 1991; 80.
- Maestroni GJ, Conti A, Lissoni P. Colony stimulating activity and hematopoetic rescue from cancer chemotherapy compounds are induced by melatonin via endogenous IL-4. Cancer Res 1994, 55: 4470—4473.
- Lissoni Р, Barni S, Mandala M, Maestroni GJM. Decreased toxicity and increased efficacy of cancer chemotherapy using the pineal hormone melatonin in metastatic solid tumour patients with poor clisnical status. Eur J Cancer 1999: 35(12).
- Lissoni P, Barni S, Tancini G, Ardizzoia A, Ricci G, Aldegpi R, Brivio F, Tisi E, Rescaldani R, and Maestroni GJM. A randomised study with subcutaneous low-dose interleukin-2 alone vs interleukin-2 plus the pineal neurohormone melatonin in advanced solid neoplsms other than renal cancer and melanoma. Br J Cancer 1994; 69.
- Lissoni P, Tisi F, Barni S Ardizzoia A, Rovelli F, Rescaldani R, Ballabio D, Benenti C,Angeli M, Tancini G, Cjnti A and Maestroni GJM. Biological and clinical results of a neuroimmunotherapy with IL-2 and the pineal hormone melatonins as a first line treatment in advanced non-small all lung cancer. Br J Cancer 1992, 66: 155-180.
- Lissoni P, Rovelli F, Frassineti F. Oncostatic activity of pineal neuroendocrine treatment with the pineal indoles melatonin and 5-methoxytryptamine in untreatable metastatic cancer patients progressing on melatonin alone. Neuroend. Letters 2000: 21(4), 319—3.
- Lissoni P, Barni S, Rovelli F, Brivio F, Ardizzoia A, Tancini G, Conti A, Maestroni GJM. Neuroimmunotherapy of advanced solid neoplasms with single evening subcutaneous injection of low-dose IL-2 and melatonin preliminary results. Eur J Cancer 1993, 29A.
- Lissoni P, Barni S, Tancini G, Rovelli F, Frassineti F, Conti A. Therapy of cancer chemotherapy-induced toxicity by the pineal hormone melatonin. Support Cancer 1997, 5.
- Лакин ГФ. Биометрия. — Москва: Высш школа, 1980. — 290 с.
Авторы:
Мосиенко Маргарита Дмитриевна — старший научный сотрудник, кандидат медицинских наук.
Линив Лилиана Степановна — аспирант.
Киреева Светлана Сергеевна — старший научный сотрудник, кандидат биологических наук.
Рябуха Василий Николаевич — научный сотрудник, кандидат биологических наук.
Мосиенко Владимир Сергеевич — ведущий научный сотрудник, доктор медицинских наук, профессор.
Share the post "ЗАЩИТА КОСТНОГО МОЗГА МЫШЕЙ ОТ ЦИКЛОФОСФАМИД-ИНДУЦИРОВАННОЙ ЦИТОСУПРЕССИИ ПРЕБИОТИЧЕСКИМ ИМУНОМОДУЛЯТОРОМ ЛИАСТЕНОМ И НЕЙРОГОРМОНОМ МЕЛАТОНИНОМ"