УДК 616. 419-092. 9:615 [. 277. 3:. 357:. 37]
THE PROTECTION OF MICE BONE MARROW FROM CYCLOPHOSPHAMIDE-INDUCED CYTOTOXITY BY PREBIOTIC IMMUNOMODULATOR BLASTEN AND NEUROHORMONE MELATONIN
M.D. Mosienko, L.S. Lyniv, S.S.Kirieieva, W.M.Ryabukha, W.S.Mosienko
R.E.Kavetsky Institute of Experimental Pathology, Oncology and Radiobiology,National Academy of Sciences of Ukraine, 03022,Kyiv,Ukraine
ЗАХИСТ КІСТКОВОГО МОЗКУ МИШЕЙ ВІД ЦИКЛОФОСФАМІД-ІНДУКОВАНОЇ ЦИТОСУПРЕСІЇ ПРЕБІОТИЧНИМ ІМУНОМОДУЛЯТОРОМ БЛАСТЕНОМ ТА НЕЙРОГОРМОНОМ МЕЛАТОНІНОМ
М. Д. Мосієнко*, Л.С.Линів, С. С. Кіреєва, В. М. Рябуха, В.С. Мосієнко
Інститут експериментальної патології, онкології і радіобіології ім. Р.Є. Кавецького НАН України, Київ, Україна
Тел./факс : 263-94-16, 266-98-27
Використані скорочення:
ЦФ — циклофосфан, ПІБ — пребіотичний імуномодулятор бластен
Досліджено вплив імуномодулятора бластену та нейрогормону мелатоніну на захист кісткового мозку мишей від індукованої циклофосфаном цитосупресії. Після багаторазових курсів циклофосфану в терапевтичних дозах у нелінійних мишей відмічено поступове зниження рівню диференціації клітин всіх гілок кровотворення, накопичення в кістковому мозку низькодиференційованих клітинних елементів, падіння рівню лейкоцитів (особливо лимфоцитів) та еритроцитів в периферичній крові. При сумісному застосуванні з циклофосфаном імуномодулятора бластену, або гормону мелатоніну виявлено ефект захисту кісткового мозку від цитотоксичної дії циклофосфану — суттєве підвищення рівня зрілих клітин лімфоїдного ряду, поступове відновлення диференціації незрілих форм гранулоцитів та збільшення рівню лімфоцитів, характерного для нормального кісткового мозку мишей. В периферичній крові відмічено значно менше падіння рівню лейкоцитів і еритроцитів в порівнянні з дією самого ЦФ.
Ключові слова: циклофосфан, імуномодулятор бластен, нейрогормон мелатонін, кістковий мозок, периферична кров.
The capacity of immunomodulator blasten and neurohormone melatonin to protect bone marrow from cyclophosphamide-induced cytotoxity was investigated. The gradual reduction in all haemopoietic cell differentiation, accumulation of low differentiated cells in bone marrow, decrease of leucocyte and erythrocyte levels in peripheral blood were observed after repeated cyclophosphamide treatment in therapeutical doses on nonbred mice. Effect of bone marrow protection from cytotoxic affect of cyclophosphamide was detected under simultaneous injection with immunomodulator blasten or with hormone melatonin. Significant increase in high differentiated lymphoid cells, gradual renewal of low differentiated granulocytes, and increase in lymphocyte level till norm for mice bone marrow. It is much less fall of lymphocyte and erythrocyte levels were detected in peripheral blood in comparison with affect of cyclophosphamide alone.
Key Words: cyclophosphamide, immunomodulator blasten, neurohormone melatonin, bone marrow, peripheral blood.
В сучасній клінічній онкології досить актуальною залишається проблема токсичності протипухлинної терапії, яка має широкий спектр ураження життєвоважливих органів та систем організму, серед яких найбільш чутливими є кістковий мозок, лімфоїдні органи, епітелій шлунково-кишкового тракту. Це призводить до зниження адаптивно-компенсаторних механізмів і являється серйозною перешкодою для подальшого продовження курсів хіміотерапії та отримання позитивних результатів при лікуванні хворих зі злоякісними пухлинами [1,2]. Незважаючи на те, що системі крові притаманні значні компенсаторні можливості, вони значно обмежені при тривалих впливах на організм цитосупресивної терапії [3—5]. Це обумовлює розробку нових підходів і експериментально обгрунтованих концепцій захисту імуно- та гемопоезу в динамиці повторних курсів хіміотерапії онкологічних хворих. Поряд з використанням специфічних, стимулюючих кровотворення засобів, які, слід зазначити, мають побічні ефекти, все частіше приділяється увага природним препаратам, з більш фізіологічними можливостями корекції гемо — та імунопоезу. Серед перспективних в цьому відношенні препаратів особливе місце займає новий оригінальний вітчизняний пребіотичний імуномодулятор бластен, отриманий з клітинних стінок молочнокислих бактерій штаму Lactobacillus Delbrueckii [6]. Експериментальні дослідження показали, що бластен у малих дозах проявляє імунокоригуючу активність по відношенню до широкого спектру реакцій гуморального та клітинного імунітету, має певну протипухлинну та антиметастатичну дію, покращує мікроциркуляцію крові [7]. Доцільно зазначити, що, на відміну від інших препаратів такої групи, бластен практично нетоксичний. В доклінічних експериментах було виявлено його здатність захищати гемо- та імунопоез, сприяти відновленню клітин кишкового епітелію після хіміотерапії ЦФ, ефективно зменшувати радіаційно індуковану цитосупресію, підсилювати протипухлинний ефект ЦФ та біотерапії плацентарними факторами, подовжувати життя опромінених тварин [8—11]. Клінічними дослідженнями встановлено здатність бластену захищати лейкопоез, підвищувати рівень ІЛ-1 та ІЛ-2 і ,що особливо важливе, підвищувати загальне 5-річне та безрецидивне виживання хворих на рак молочної залози за неоад’ювантним комплексним лікуванням [12]. Але незважаючи на накопичений досвід застосування бластену, залишаються невирішенними питання про його вплив на кістковий мозок та периферичну кров, особливо після багаторазових курсів хіміотерапії. В даному аспекті увагу дослідників привертає і гормон епіфізу — мелатонін [13]. Дослідження гормону мелатоніну як засобу захисту кісткового мозку обумовлено його природними імуномодулюючими властивостями, здатністю стабілізувати геном клітини при дії генотоксичних факторів, пригнічувати проліферацію в злоякісних пухлинах, а згідно останнім даним, мелатонін розглядають також як природну антиангіогенну молекулу в організмі [14—16]. Показано його прямий онкостатичний вплив за допомогою контролю експресії онкогенів, індукції апоптозу в трансформованих клітинах, інгібування вільних радикалів та імуномодулююча активність шляхом вивільнення ІЛ-2, ІЛ-4, ІЛ-6 [17—24]. Застосування мелатоніну в фармакологічних дозах також може бути перспективним при лікуванні злоякісних новоутворень з метою попередження виникнення мутацій в нормальних клітинах та вторинних пухлин при дії на організм опромінення та протипухлинних препаратів [25—27].
З цих позицій метою роботи було вивчити в експерименті можливість захисту кісткового мозку і периферичної крові за допомогою імуномодулятора бластену та пінеального гормону мелатоніну за повторними курсами введення циклофосфану у інтактних мишей.
Методика досліджень
Експерименти проведено на 60-и інтактних нелінійних мишах — самцях віком 2,5—3 місяці, масою 23—25 г, розведення віварію ІЕПОР ім. Р.Є.Кавецького НАН України. Матеріалом дослідження були кістковий мозок епіфізу стегнової кістки та периферична кров.
Хіміопрепарат циклофосфан (Україна, ОАО Киевмедпрепарат) вводили підшкірно, у дозі 150 мг/кг на курс, тричі, з інтервалом 10—12 діб. Імуномодулятор бластен (Україна, м. Ладижин, ВТО «Ензим») вводили у дозі 1/ 1000 (7 мг/кг маси тіла) та 1/ 75000 (0,09 мг/кг маси тіла) від ЛД50 (7000 мг/кг), підшкірно, за добу перед ін’єкціями ЦФ. Гормон мелатонін (США, Sigma), застосовували у дозі 5 мг/кг, підшкірно, по одній ін’єкції щоденно напротязі 10 діб після курсового введення ЦФ, та 3 ін’єкції — після закінчення останнього курсу ЦФ ( за 3 курси хіміотерапії — всього 23 ін’єкції ), о 17год.
Мишей розподілили на такі групи: 1-а — контрольна, введення фізіологічного розчину, 8 тварин; 2-а — введення самого ЦФ, 14 тварин; 3-я — введення бластену у дозі 1/1000 від ЛД50 + ЦФ, 14 тварин; 4-а — введення бластену у дозі 1/75000 від ЛД50 + ЦФ, 14 тварин; 5-та — ЦФ+мелатонін, 10 тварин.
Враховуючи дані літератури про те, що найбільше пригнічення кісткового мозку та периферичної крові відмічається на 3—5 добу після введення циклофосфану, в ці строки декапітацією забивали по 4—5 тварин з кожної групи, у яких стандартними методиками досліджувались мієлограми кісткового мозку (забарвленням по Паппенгейму), мазки периферичної крові (забарвленням по Романовському — Гімза), загальновживаним методом в камері Горяєва визначали абсолютну кількість лейкоцитів та еритроцитів периферичної крові.
Результати експериментів оброблено статистично за використанням t -критерію Стьюдента [28].
Результати досліджень та їх обговорення
За введенням в терапевтичній дозі одного ЦФ у мієлограмах мишей відмічено поступове зниження рівню диференціації клітин всіх гілок кровотворення (Табл.1), що призводить до накопичення в кістковому мозку низькодиференційованих клітинних елементів, а в мазках периферичної крові проявляється в падінні рівню лімфоцитів
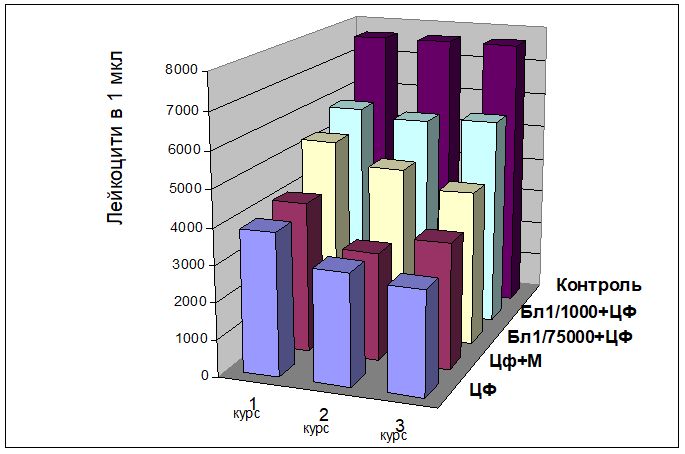
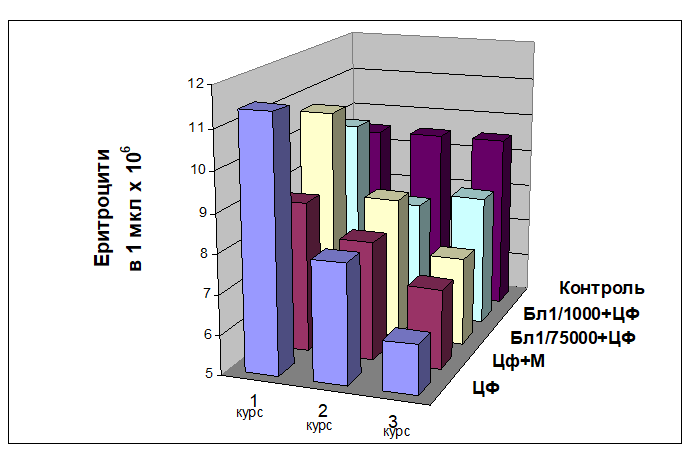
(Табл. 2.). Кістковий мозок набував промієлоцитарно-мієлоцитарний характер. Так, якщо після 1-ої ін’єкції рівень метамієлоцитів складав 10,6±2,2%, то після 2-ї піднімався до 19,5±0,2% (45%), а після 3-ї — дорівнював 21,1±1,6% (50%) Кількість мієлоцитів складала 6,8±2,0%, 8,6±1,5% та 8,5±1,7% після 1-ї, 2-ї та 3-ї ін’єкцій ЦФ відповідно. Із кожним наступним введення ЦФ спостерігається прогресування лейкопенії. Рівні паличкоядерних та сегментоядерних нейтрофілів після 2-ї ін’єкції складали 19,5±1,2% та 23,3±2,2%, що було вище, ніж в контрольній групі (18,5±1,2% та 19,3±2,2% відповідно). Такий рівень зрілих нейтрофільних лейкоцитів свідчить про активацію захисних механізмів кісткового мозку. Про порушення дозрівання свідчить і токсична грануляція нейтрофілів, їх гіперсегментація, збільшення розмірів ядер та самих клітин. В периферичній крові спостерігались дегенеративні зміни: пікноз, хроматиноліз, гіперсегментація нейтрофілів, вакуолізація. Помічена токсична грануляція лейкоцитів нейтрофільного ряду, збільшення розмірів як ядер, так і самих клітин. В мазках периферичної крові відмічалось підвищення процентного співвідношення гранулоцитарних лейкоцитів, яке, можливо, обумовлено постачанням клітин з кісткового мозку. Ці зсуви в кістковому мозку відбуваються за рахунок пригнічення процесів проліферації та гальмування утворення і дозрівання кров’яних елементів із поліпотентних клітин попередників — стовбурових клітин. Кількість лімфоцитів була знижена, як в кістковому мозку, так і в периферичній крові (7,2±1,2% та 8,1±1,5% і 47,5±3,2% (65%) та 51,5±3,2% (69%) відповідно після 2-ої та після 3-ої ін’єкції) в порівнянні з контролем (відповідно 72,6±4,6% та 73,6±3,4%). Серед лімфоцитів спостерігались клітини із вакуолізацією та обірваними краями. Таким чином, відмічені кількісні та якісні зміни в клітинах лімфоцитарного ряду свідчать про цитотоксичну дію ЦФ на кістковий мозок. Крім того, відмічено незначне (Р < 0,05) коливання рівню моноцитів в кістковому мозку і периферичній крові, що також свідчить про реакцію на цитотоксичну дію препарату. При морфологічному дослідженні периферичної крові в динамиці трьох курсів хіміотерапії це проявляється поступовим зниженням кількості лейкоцитів відповідно на 48,9%, 60,0% і 62,6%, короткочасним підвищенням кількості еритроцитів на 11,9% після першого введення ЦФ, та подальшим поступовим зниженням цього показника на 16,1 % після другого і на 34,3% після третього курсу ЦФ (Мал. 1).
При цитологічному аналізі мієлограм кісткового мозку за використанням імуномодулятора бластену виявлено, що він, незважаючи на вплив цитостатика, вже на 3-ю добу після його введення суттєво підтримує лімфоїдний ряд кровотворення. Якщо при дії самого ЦФ кількість лімфоцитів в кістковому мозку була нижчою, ніж в контрольній групі, то за введенням бластену рівень лімфоцитів перевищував норму. При цьому за використанням бластену у 1/1000 від ЛД50 рівень лімфоцитів складав 13,5±2,6% (1-а ін.), 14,8±1,7% ( 2-а ін.) та навіть 21,3±1,9% (3-я ін.). Однак спостерігались поодинокі клітини з бахромчатою цитоплазмою та вакуолізацією. При використанні бластену у 1/75000 від ЛД50 рівень лімфоцитів дорівнював 12,6±1,2%, 13,0±0,6% та навіть 19,3±2,9% ( відповідно 1-а, 2-а та 3-я ін’єкція) (Табл.1.). Тобто ефективнішою виявилась доза бластену 1/1000 від ЛД50. Більш того, помічено стимулювання диференціації гранулоцитарної гілки кровотворення. Якщо при дії лише ЦФ ядра деяких мієлоцітів і промієлоцитів були фрагментовані, то при дії бластену з ЦФ якісні зміни спостерігались лише в зрілих нейтрофільних лейкоцитах, які були значно збільшені в розмірах. У порівнянні із цитостатиком не спостерігалась фрагментація ядер з відщепленням ядерної субстанції та формування окремо лежачих утворень, в меншій мірі була наявна токсична зернистість. Так, високодиференційованих клітин нейтрофільного ряду — сегментоядерних лейкоцитів після 2-ого курсу ЦФ нараховувалось 26,6±1,21% і 24,6±2,33% відповідно при більшій і малий дозі бластену, в той час як при дії лише самого ЦФ- 23,3±2,21%. Після 2-ого та 3-ього курсів хіміотерапії ЦФ з бластеном виявлено меншу кількість метамієлоцитів (менш диференційованих клітин-попередників нейтрофільних лейкоцитів) — 18,5±1,21% і 17,1±1,35% та 19,5±1.67% і 20,5±1,61% відповідно дозі бластену( 1/1000 і 1/75000 від ЛД50) порівняно з 19,5±1,21% і 21,1±1,61% при дії самого ЦФ. Однак не відмічено впливу бластену на еритроїдний ряд, так кількість еритробластів складала 2,0±0% та 2,3±0,2% в залежності від дози в порівнянні із 2,0 ±0% при дії самого ЦФ. В той же час в контрольній групі у інтактних мишей нараховувалось 0,3 ±0,21% цих клітин. А поліхроматофільних нормоцитів виявилось 4,9±1,67 та 4,5±3,6 (1 та 2 дози бластену) у порівнянні із 5,0±0,56 при дії самого ЦФ. Рівень загиблих клітин був значно нижчий. Таким чином виявлено, що введення імуномодулятора бластену за добу до ЦФ призводить до стимуляції диференціації гранулоцитарних лейкоцитів та до збільшення рівню клітин лімфоїдного ряду. Процес регенерації був обумовлений активною проліферацією молодих гемопоетичних елементів, який змінювався на прискорення процесів дозрівання і викиду зрілих клітин в периферичну кров. В периферичній крові відновлення гемопоетичної тканини відбувається з участю глибинних резервів кровотворення: перехідних гемогістоїдних елементів, які диференціюються в сторону мієлоїдної гілки. Переходом гемогістобластів в нейтрофіли, минаючи ряди проміжних стадій та наявністю скорочених шляхів диференціації можна пояснити таку швидку гемопоетичну функцію, враховуючи також відому імуномодулюючу властивість препарату. Однак не відмічено впливу бластену на еритроїдну гілку кровотворення. В той же час виявлено чітку позитивну динамику відновлення порушень морфологічного складу показників периферичної крові після тривалої дії цитостатика. Незважаючи на те, що кожен наступний курс введення ЦФ посилював лейкопенію, ії рівень був суттєво (Р < 0,05) нижчим за превентивним введенням бластену. Так кількість лейкоцитів після трьох курсів ЦФ знизилась тільки на 24,4 % при дозі бластену 1/1000 і на 44,1 % — при дозі бластену 1/75000, в порівнянні з 62,6 % при дії самого ЦФ, а кількість еритроцитів — на 12,2%, 23,8 % і 34,3 % відповідно (Мал. 1).
При сумісному введенні ЦФ та мелатоніну у цитограмах кісткового мозку виявлено поступове відновлення диференціації незрілих форм гранулоцитів та збільшення рівню лімфоцитів, а в мазках периферичної крові — підвищення рівню лейкоцитів до їх показників в контрольній групі тварин (Табл.1, 2). Так, в кістковому мозку із нейтрофільних гранулоцитів — метамієлоцитів нараховувалось 14±0,5%, 13,8±0,5% та 14,02,7% (1-а, 2-а та 3-я ін’єкції відповідно). Високодиференційованих клітин — сегментоядерних лейкоцитів відмічено 20,1±2,5%, 25,5±1,2% та 26,5±1,2% відповідно. Рівень лімфоцитів складав 20,6±2,3% після 3-ї ін’єкції, в той час як при використанні лише самого ЦФ — 10,1±1,5%. Із даних літератури та наших попередніх досліджень відомо, що мелатонін інгібує поліпотентну стовбурову клітину та стимулює більш зрілі клітини до диференціації, стимулюючи лімфоцити до виділення інтерлейкінів, які в свою чергу впливають на виділення клітинами строми гранулоцит-макрофаг колонійоформуючих одиниць[ 9-13]. Вищенаведене свідчить про те, що мелатонін у фармакологічних дозах суттєво корегує індуковані ЦФ цитотоксичні зміни в лімфоцитарному та еритроїдному рядах кровотворення. Однак в динамиці трьох курсів хіміотерапії ЦФ з використанням мелатоніну не було виявлено суттєвих відмінностей в морфологічному складі периферичної крові порівняно з дією самого ЦФ. Можливо це пов’язано з ранніми строками визначення досліджених показників, оскільки згідно даним літератури при інших схемах такий ефект було продемонстровано. В наших дослідах після 3-ого курсу хіміотерапії вже почала виявлятись позитивна динаміка відновлення показників білої і красної крові, що підтверджує дані літератури про пролонгований ефект мелатоніну.
Таким чином, багаторазове курсове введення ЦФ призводить до розвитку лейкопенії, лімфоцитопенії, зниженню кількості лімфоцитів та еритроцитів у периферичній крові нелінійних мишей. Превентивне введення імуномодулятора бластену, або терапевтичне введення гормону мелатоніну в процесі хіміотерапії ЦФ сприяє захисту кісткового мозку і периферичної крові від цитосупресивної дії цитостатика. При цьому ефективнішою виявилась доза бластена 1/1000 від ЛД50 (7 мг/кг). Дані літератури свідчать, що за іншою схемою його застосування більш ефективно корегували негативний вплив однокурсового введення ЦФ на гемо- та імунопоез низькі дози бластену (0,07-0,09 мг/кг) [8]. Таким чином використання пребіотичного імуномодулятора бластену і нейрогормону мелатоніну надає можливість зменшити побічні ефекти хіміотерапії, а саме — ії цитосупресивну дію на кістковий мозок, периферичну кров і тим самим продовжити заплановані курси лікування онкологічних хворих.
Порівняльний аналіз ефектів захисту кісткового мозку від цитотоксичної дії циклофосфану імуномодулятором бластеном та гормоном мелатоніном показав, що бластен суттєво підвищує рівень клітин гранулоцитарного ряду на різних стадіях їх диференціації. В свою чергу індольний гормон мелатонін стимулює диференціацію клітин-попередників як мієлопоезу, лімфопоезу, так еритропоезу.
Таблиця 1.
КЛІТИННИЙ СКЛАД (%) КІСТКОВОГО МОЗКУ НЕЛІНІЙНИХ МИШЕЙ
В ДИНАМІЦІ КУРСОВОГО ВВЕДЕННЯ ЦИКЛОФОСФАНУ
| Клітинні елементи | Групи мишей | ||||||||||
| 1 | 2 | 3 | 4 | 5 | |||||||
І курс ЦФ |
|||||||||||
| Промієлоцити | 2,5±0,42 | 3,0±0,67 | 2,6±1,2 | 2,9±0,47 | 3,1±0,61 | ||||||
| Мієлоцити | 7,1±,35 | 6,8±2,0 | 7,0±1,67 | 7,9±1,61 | 8,0±0,36 | ||||||
| Метамієлоцити | 13±1,21 | 10,6±2,21 | 10,1 ±1,47 | 12,6±1,49 | 14±0,51 | ||||||
| Паличкоядерні лейкоцити | 18,6±2,21 | 19,8±1,0 | 18,5±1,21 | 17,1±1,35 | 19,1±1,47 | ||||||
| Сегментоядерні лейкоцити | 22,6±1,33 | 20,8±2,0 | 20,5±1,21 | 21,6±1,33 | 20,1±2,47 | ||||||
| Моноцити | 3,0±0,36 | 3,8±1,0 | 3,4±1,71 | 3,1±1,61 | 3,8±0,47 | ||||||
| Лімфоцити | 13,3±1,21 | 13,0±1,51 | 13,5±2,67 | 12,6±1,21 | 13,1±2,47 | ||||||
| Еритробласти | 0,6±0,21 | 1,0±0 | 1,3±0,21 | 0,5±0,22 | 0,66±0,21 | ||||||
| Поліхроматофільні нормоцити | 9,6±0,21 | 10,1±1,61 | 10,5±1Л | 10,1±1,47 | 11,6±1,49 | ||||||
ІІ курс ЦФ |
|||||||||||
| Промієлоцити | 2,5±1,42 | 4,1±0,б1 | 4,0±0,67 | 4,3±0,21 | 3,0±0,67 | ||||||
| Мієлоцити | 7,0±1,67 | 8,6±1,49 | 8,3±1,21 | 8,5±1,67 | 7,0±1,б7 | ||||||
| Метамієлоцити | 12,6±0,49 | 19,5±0,22 | 17,6±1,49 | 16,0±0,57 | 13,8±0,47 | ||||||
| Паличкоядерні лейкоцити | 18,5±1,21 | 19,5±1,21 | 18,6±2,71 | 19,5±2,67 | 17.8±2,47 | ||||||
| Сегментоядерні лейкоцити | 19,3±2,21 | 23,3±2,21 | 26,6±1,21 | 24,6±2,23 | 25,5±1,22 | ||||||
| Моноцити | 3,5±0,42 | 4,1±0,47 | 3,6±0,71 | 3,5±1,67 | 4,5±0,67 | ||||||
| Лімфоцити | 11,6±1,71 | 9,6±1,21 | 14,8±1,71 | 13,0±0,57 | 12,6±0,49 | ||||||
| Еритробласти | 0,5±0,22 | 1,6±0,49 | 1,3±0,21 | 2,0±0 | 3,3±0,21 | ||||||
| Поліхроматофільні нормоцити | 9,6±0,21 | 4,6±0,21 | 5,0±0,57 | 5,6±1,21 | 7,5±3,6 | ||||||
ІІІ курс ЦФ |
|||||||||||
| Промієлоцити | 3,0±0,67 | 4,6±0,71 | 4,0±0,67 | 4,0±0,67 | 3,0±0,67 | ||||||
| Мієлоцити | 7,9±1,67 | 8,5±1,67 | 8,5±1,67 | 7,0±1,67 | 8,0±0,33 | ||||||
| Метамієлоцити | 12,64=1,21 | 21,1±1,61 | 19,6±1,49 | 20,5±1,21 | 14,0±2,б7 | ||||||
| Паличкоядерні лейкоцити | 19,8±2,0 | 22,1±2,61 | 19,5±1,67 | 18,5±1,67 | 19,6±171 | ||||||
| Сегментоядерні лейкоцити | 21,3±2,21 | 19,6±2,71 | 23,6±1,21 | 22,3±2,67 | 26,5±1,22 | ||||||
| Моноцити | 2,6±0,49 | 4,0±0,67 | 4,5±0,67 | 4,3±0,21 | 4,6±0,71 | ||||||
| Лімфоцити | 13,6±2,33 | 10,1±1,47 | 21,3±1,88 | 19,3±2,88 | 20,6±2,33 | ||||||
| Еритробласти | 0,3±0,21 | 2,0±0 | 2,0±0 | 2,3±0,21 | 0,6±0,71 | ||||||
| Поліхроматофі льні нормоцити | 7,9±1,67 | 5,0±0,57 | 4,9±1,67 | 4,5±3,6 | 6,0±0,57 | ||||||
Таблиця 2.
Динамика деяких показників (%) лейкоцитарної формули периферичної крові нелінійних мишей в процесі багаторазових курсів хіміотерапії ЦФ
| Показник, Групи мишей | Курси хіміотерапії ЦФ | ||
| 1-й | 2-й | 3-й | |
| Сегментоядерні нейтрофіли | |||
| 1. Інтактний контроль | 18,6 ± 2,21 | 16,6 ± 2,71 | 19,1 ± 1,66 |
| 2. ЦФ | 20,3 ± 2,66 | 28,6 ± 3,66 | 24,6 ± 3,66 |
| 3. ПІБ (7 мг/кг) + ЦФ | 9,3 ± 1,66 | 25,5 ± 2,22 | 21,6 ± 2,21 |
| 4. ПІБ (0,09 мг/кг)+ЦФ | 6,8 ± 1,79 | 22,6 ± 2,21 | 22,3 ± 2,66 |
| 5. ЦФ+ мелатонін | 19,1 ± 2,47 | 16,6 ± 1,71 | 23,8 ± 1,79 |
| Лімфоцити | |||
| 1. Інтактний контроль | 70,6 ± 3,49 | 72,6 ± 4,67 | 73,6 ± 3,4 |
| 2. ЦФ | 66,8 ± 3,79 | 60,5 ± 3,21 | 62,5 ± 3,21 |
| 3. ПІБ (7 мг/кг) + ЦФ | 70,1 ± 4,35 | 66,6 ± 3,66 | 71,1 ± 4,35 |
| 4. ПІБ (0,09 мг/кг)+ЦФ | 74,3 ± 3,66 | 63,6 ± 2,7 | 70,3 ± 3,66 |
| 5. ЦФ+ мелатонін | 72,4 ± 2,71 | 64,6 ± 2,33 | 69,6 ± 3,66 |
| Моноцити | |||
| 1. Інтактний контроль | 9,1 ± 1,61 | 8,6 ± 1,71 | 8,6 ± 0,33 |
| 2. ЦФ | 8,6 ± 1,33 | 7,6 ± 1,33 | 6,6 ± 1,71 |
| 3. ПІБ (7 мг/кг) + ЦФ | 7,6 ± 1,33 | 6,6 ± 1,71 | 7,3 ± 1,66 |
| 4. ПІБ (0,09 мг/кг)+ЦФ | 6,6 ± 1,33 | 6,6 ± 0,49 | 7,6 ± 1,33 |
| 5. ЦФ+ мелатонін | 8,6 ± 0,33 | 6,6 ± 0,49 | 8,6 ± 0,33 |
ЛІТЕРАТУРА
- Мосиенко ВС. Возможности, недостатки и перспективы лекарственной терапии опухолевой болезни. Українськ хіміотерапевт журн 2000, 1: 10—14.
- Montero MC, Valdivia ML, Carvajal E. Economic study of neutropenia induced by mieloxic chemotherapy. Pharm World Sci 1994; 16: 187—192.
- Гольдберг ДИ, Дедова ЛС. Действие массивных доз циклофосфана на кроветворение в эксперименте. Вопр онкол 1969, 15(4): 82—7.
- Пінчук ЛБ, Родіонова НК. Зміни в системі кістковомозкового кровотворення у тварин, які постійно утримувались у Чорнобильській зоні відчуження. В: Чорнобиль. Зона відчуження. Збірник праць Київ Наук. Думка, 2001; 429—435.
- Гольдберг ДИ,
- Патент 20509, А61К 35/74, С 12 1/20. Біотехнологічний спосіб одержання імуномодулюючого препарату. Болоховська ВА, Волкова МЮ, Воспяков ВГ, Даниленко ВС, Латишевська ГВ, Мартинюк НБ, Мосієнко ВС, Мосієнко МД, Савцова ЗД, Сойченко ВВ, Шинкаренко ЛМ, Щеглова НА. — АТНБЦ «Ензифарм», UA. — № 95083935; заявл.28.08.95.; публ. 15.07.97.
- Мосієнко ВС, Мосієнко МД, Савцова ЗД, Даниленко ВС, Волкова МЮ, Шинкаренко ЛМ, Щеглова НА, Восп’яков ВГ, Свідро ОВ, Меньок ТА. Бластен — новий вітчизняний імуномодулятор біологічного походження. Журн АМН України 1999; 5(1): 79—86.
- Менек ТА, Воейкова ИМ, Юдина ОЮ, Мосиенко ВС, Шинкаренко ЛН, Савцова ЗД. Влияние иммуномодулятора из Lactobacillus Delbrueckii на терапевтическую эффективность циклофосфамида у мышей с карциномой Льюис. Эксп Онкол 2000, 22(4): 211—14.
- Мосиенко ВС, Савцова ЗД, Менек ТА, Мосиенко МД, Касьяненко ИВ, Шинкаренко ЛН. Эффективность иммуномодулятора бластен в профилактике и лечении лучевой и химической цитосупрессии. Імунол та алергол 1999, (3): 54.
- Савцова ЗД, Меньок ТА, Джаман НШ, Воєйкова ІМ, Ковбасюк СА, Мосієнко ВС. Дозозалежність впливу імуномодулятора мікробного походження на дискретні показники крові та лімфоїдних органів опромінених тварин. Наук записки НаУКМА біол та екологія 2000, 18: 25—30.
- Мосієнко МД, Рябуха ВМ, Пясковська ОМ, Мосієнко ВС, Вінницький ВБ. Протипухлинна активність превентивної імунізації мишей С57Вl/6 з карциномою Льюїс плацентарними факторами та імуномодулятором пребіотичного походження бластеном. Эксп онкол 2001, 4: 278—81.
- Тарутинов ВИ, Мосиенко ВС, Касьяненко ИВ, Шпилевая СИ, Рогацкая ВП, Хруленко ЛТ, Пономарев ИО, Гулак ЛО, Мосиенко МД, Пивнюк ВМ, Шинкаренко ЛН, Воспяков ВГ, Чехун ВФ. Выживаемость больных раком молочной железы при комплексном лечении с использованием природного иммуномодулятора из Lactobacillus Delbrueckii. Укр хіміотерапевт журн 2001; 2(10): 51—56.
- Brzezinski А. Mechanisms of disease: melatonin in humans.The New Eng J Medicine 1997: 336(3), 186—
- Vanecek J. Mechanisms of melatonin action. Physiol Res 1998, 40(1): 11—
- Blask DE. Melatonin in oncology. In: Melatonin. Biosynthesis, physiological effects and clinical applications.H.-S. R.J. Reiter eds. CRC Press, Boca Raton, 1993; 447-475.
- Lissoni P, Rovelli F, Malugani F, Maestroni GJM. Anti-angiogenic activity of melatonin in advanced cancer patients. Neuroend. Letters 2001: 22, 45—47.
- Линів ЛС, Кірєєва СС, Шишко ЕД, Вінницький ВБ. Гормон епіфізу мелатонін. Біологічні функції, механізми дії та перспективи застосування. Вісник проблем біолог і медиц 2000; 4: 5—15.
- KoratkarR, VasudhaA, RameshG, Padma M, Das UN. Effects of melatonin on cis-platinum-induced genetic damage to the bone marrow cells of mice.Med.Sci.Res. — 1992:(20), 179—
- Reiter R, Tang Lei. Garcia JJ, Munoz-Hoyos A. Pharmacological actions of melatonin in oxygen radical pathophysiology. Life Sci 1997, 60: 2255—
- Lissoni P, Barni. S, Cataneo E, Ardizzoia A, Tancini G, Maestroni GJM. Pineal-interleukin-2 interaction and their possible importance in the pathogenesis of immune dysfuntions in cancer. In Role of melatonin and pineal peptides in neuroimmunomodulation . Fraschini E, Reiter RE. New York: Plenum Press 1991; 80.
- Maestroni GJ, Conti A, Lissoni P. Colony stimulating activity and hematopoetic rescue from cancer chemotherapy compounds are induced by melatonin via endogenous IL-4. Cancer Res 1994, 55: 4470—4473.
- Lissoni Р, Barni S, Mandala M, Maestroni GJM. Decreased toxicity and increased efficacy of cancer chemotherapy using the pineal hormone melatonin in metastatic solid tumour patients with poor clisnical status. Eur J Cancer 1999: 35(12), 1688—
- Lissoni P, Barni S, Tancini G, Ardizzoia A, Ricci G, Aldegpi R, Brivio F, Tisi E, Rescaldani R, and Maestroni GJM. A randomised study with subcutaneous low-dose interleukin-2 alone vs interleukin-2 plus the pineal neurohormone melatonin in advanced solid neoplsms other than renal cancer and melanoma. Br J Cancer 1994; 69: 196—
- Lissoni P, Tisi F, Barni S Ardizzoia A, Rovelli F, Rescaldani R, Ballabio D, Benenti C,Angeli M, Tancini G, Cjnti A and Maestroni GJM. Biological and clinical results of a neuroimmunotherapy with IL-2 and the pineal hormone melatonins as a first line treatment in advanced non-small all lung cancer. Br J Cancer 1992, 66: 155-180.
- Lissoni P, Rovelli F, Frassineti F. Oncostatic activity of pineal neuroendocrine treatment with the pineal indoles melatonin and 5-methoxytryptamine in untreatable metastatic cancer patients progressing on melatonin alone. Neuroend. Letters 2000: 21(4), 319—3.
- Lissoni P, Barni S, Rovelli F, Brivio F, Ardizzoia A, Tancini G, Conti A, Maestroni GJM. Neuroimmunotherapy of advanced solid neoplasms with single evening subcutaneous injection of low-dose IL-2 and melatonin preliminary results. Eur J Cancer 1993, 29A: 185—
- Lissoni P, Barni S, Tancini G, Rovelli F, Frassineti F, Conti A. Therapy of cancer chemotherapy-induced toxicity by the pineal hormone melatonin. Support Cancer 1997, 5: 126—
- Лакин ГФ. Биометрия. — Москва: Высш школа, 1980. — 290 с.
ДИНАМІКА ВМІСТУ ЛЕЙКОЦИТІВ В ПЕРИФЕРИЧНІЙ КРОВІ НЕЛІНІЙНИХ МИШЕЙ ПРИ ДІЇ ЦИКЛОФОСФАНУ ТА В ПОЄДНАННІ ЙОГО З БЛАСТЕНОМ АБО МЕЛАТОНІНОМ
ДИНАМІКА ВМІСТУ ЕРИТРОЦИТІВ В ПЕРИФЕРИЧНІЙ КРОВІ НЕЛІНІЙНИХ МИШЕЙ ПРИ ДІЇ ЦИКЛОФОСФАНУ ТА В ПОЄДНАННІ ЙОГО З БЛАСТЕНОМ АБО МЕЛАТОНІНОМ
Автори:
Мосієнко Маргарита Дмитрівна
Старший науковий співробітник
Кандидат медичних наук
Линів Ліліана Степанівна
Аспірант
Кіреєва Светлана Сергійовна
Старший науковий співробітник
Кандидат біологічних наук
Рябуха Василь Миколаєвич
Науковий співробітник
Кандидат біологічних наук
Мосієнко Володимир Сергійович
Ведучий науковий співробітник
Доктор медичних наук,професор
Share the post "Захист кісткового мозку мишей від циклофосфамід-індукованої цитосупресії пребіотичним імуномодулятором бластеном та нейрогормоном мелатоніном "