О.С. Готько, д.мед.н., професор, завідувач кафедри клінічної онкології та променевих методів діагностики Ужгородського національного університету
Вступ
Останніми десятиріччями, в багатьох країнах світу, в тому числі й в Україні, зростає захворюваність на рак товстої кишки (РТК). Нині, у структурі онкологічної захворюваності, РТК вийшов третє місце. Захворюваність на злоякісні новоутворення сліпої та ободової кишок серед чоловіків складає 11,6, а серед жінок – 9,2 на 100 тис. дорослого населення. Захворюваність на рак прямої кишки серед чоловіків склала 11,0, а серед жінок – 7,1 на 100 000 населення. [1, 6]. У деяких країнах Західної Європи та Америки, колоректальний рак (КРР) за частотою перемістився на друге місце. У США, щорічно виявляють 150 000 нових випадків злоякісних новоутворень товстої кишки. Частіше, РТК виявляється в осіб, старших за 50 років із поступовим зниженням рівня захворюваності у групах населення віком понад 75 років [2, 4]. Але, попри досить явне збільшення частоти РТК у старших вікових групах, все частіше це захворювання діагностують і в молодому віці, особливо спадкові форми захворювання. За таких умов, проблема діагностики та лікування РТК набуває важливого соціального значення.
До лікування пацієнтів, хворих на КРР, необхідно підходити комплексно. Беззаперечно, основним методом лікування є хірургічне втручання. Останнього десятиріччя, резектабельність РТК складає 70–80%, а післяопераційна летальність зменшилася до 5%. Показники виживання хворих протягом п’яти років, у більшості країн коливаються в діапазоні 50-60%. Променеву терапію включають до стандарту лікування раку прямої кишки на передопераційному етапі, для зменшення стадійності, та післяопераційно – для зменшення частоти локальних рецидивів і як основний метод лікування неоперабельного локально поширеного раку. При цьому було проведено безліч досліджень, котрі дозволили підібрати оптимальний режим ад’ювантної терапії для лікування хворих на РТК.
Частина хворих з II та всі хворі з III стадією (стадії В та С по Dukes), повинні отримувати ад’ювантну терапію – допоміжне, таке, що доповнює хірургічні та променеві методи, медикаментозне лікування. Іноді таку терапію називають профілактичною. Мету ад’ювантної терапії становить ерадикація мікрометастазів раку після видалення або променевого лікування первинної пухлини, оскільки вони стають причиною незадовільних результатів хірургічного чи променевого лікування первинного пухлинного вогнища. У зв’язку з цим, завданнями ад’ювантної хіміотерапії стають: збільшення тривалості безрецидивного періоду, зменшення частоти розвитку рецидивів хвороби та, завдяки цьому – збільшення тривалості життя хворих. Для здійснення ад’ювантної хіміотерапії застосовують протипухлинні агенти, високоактивні щодо даного типу пухлини. Терапія має бути тривалою, що зумовлене гетерогенністю популяції пухлинних клітин та переривчастою (зазвичай, внаслідок токсичності відповідних препаратів) хіміотерапією. Цей напрямок містить у собі таку небезпеку, як розвиток рецидиву хвороби або вторинних пухлин, із резистентністю до проведеного лікарського лікування. Однак правильне застосування ад’ювантної хіміотерапії дає змогу довести її переваги за цілої низки злоякісних новоутворень людини, у тому числі і у разі колоректального раку [3, 7].
Одним з найефективніших препаратів у лікуванні РТК, є 5-фторурацил та його комбінації з левамізолом, лейковорином та ін. Остаточно, позитивна думка серед онкологів щодо цінності профілактичного застосування фторурацилу та левамізолу, склалася після оприлюднення висновків міжгрупового міжнародного дослідження (Moertel). На тлі такої терапії, у групі хворих зі стадією Dukes С, летальність скоротилася на 33%, а частота рецидивів – на 41% у порівнянні з контролем. Проте ця комбінація, за популярністю поступається режиму фторурацил + кальцію фолінат. З нових препаратів, котрі продемонстрували активність щодо РТК, слід відзначити оксаліплатин, котрий належить до 3-ї генерації не нефротоксичних похідних платини. У комбінації з фторурацилом та лейковорином, він стає одним з найбільш ефективних режимів хіміотерапії при метастатичному колоректальному раку [9-11]. Ефективність застосування оксаліплатину у хворих на РТК кишки II та III стадій, підтверджено у міжнародному багатоцентровому дослідженні MOSAIC [8].
Відомо, що під час проведення хіміотерапії, цитостатичне пошкодження кровотворних клітин кісткового мозку призводить до зниження числа лейкоцитів, тромбоцитів та еритроцитів. Найбільшою небезпекою при цьому стає розвиток нейтропенії, тому що нейтрофіли є одним із головних компонентів природного захисту організму проти інфекцій. Ступінь і тривалість нейтропенії, котра виникає після хіміотерапії, значною мірою визначає кількість життєво небезпечних інфекційних ускладнень. Однак малообґрунтоване призначення антибактеріальних препаратів та антимікотиків з профілактичною метою, нерідко призводить до погіршення стану хворих та ускладнення перебігу основного захворювання через імуносупресивні властивості цих препаратів, а також їх поширені гепатотоксичні та нефротоксичні ефекти. У зв’язку з цим, онкологи вбачають перспективу у застосуванні ефективних та відносно безпечних імунокоректорів пептидного походження, котрі останніми роками добре зарекомендували себе у клінічній практиці.
Одним із таких препаратів є Ліастен (глюкозамінілмурамілпентапептид – (ГМПП) – оригінальний вітчизняний імуномодулятор виробництва ДП «Ензим», Україна, препарат природного походження з широким спектром дії. Препарат являє собою фрагменти клітинної стінки лактобактерій. Він стимулює функцію макрофагів та нормалізує кількість Т-лімфоцитів; активує клітини моноцитарно-макрофагального ряду, фагоцитоз, підвищує активність лізосомальних ферментів, продукцію активних форм кисню, посилює цитотоксичний ефект макрофагів щодо пухлинних клітин. Препарат посилює синтез прозапальних цитокінів, зокрема інтерлейкіну-1, підвищує цитотоксичну активність природних клітин-кілерів. Імуномоделююча активність препарату проявляється також у тому, що він зберігає ендокринну функцію тимусу, сприяє зменшенню рівня імунних комплексів, що циркулюють. Крім того, препарат сприяє стимуляції лейкопоезу, має слабку антиметастатичну та протипухлинну дію, зменшує вираженість побічних ефектів хіміо- та променевої терапії.
Препарат призначають у якості імуномоделюючого засобу при різних захворюваннях, котрі супроводжуються вторинним імунодефіцитом, лейкопенією, зокрема у разі проведення хіміо- та променевої терапії хворим онкологічного профілю та пацієнтам з лейкозом із метою послаблення токсичної дії цитостатиків; при гострих та хронічних променевих ураженнях; при хірургічному лікуванні онкологічних захворювань та пацієнтів інших категорій. Він також показаний у разі гострих та хронічних бактеріальних та вірусних інфекцій, для лікування пацієнтів з лейкопенією різного походження.
Матеріали та методи
Метою нашої роботи стало порівняння ефективності та безпеки ад’ювантних схем терапії хворих на КРР з імуномоделюючим препаратом мурамілпептидного ряду (ГМПП) і без нього. До дослідження було включено 60 пацієнтів (11 жінок та 49 чоловіків) віком від 46 до 69 років з різними стадіями КРР згідно з класифікацією TNM та з різним обсягом проведеного оперативного втручання (таблиця 1).
Таблиця 1
Характеристика хворих на КРР за стадіями захворювання
| Стадія | TNM | Усі хворі | Основна группа | Контрольна группа | ||||
| Абс. | % | Абс. | % | Абс. | % | |||
| I | T1N0M0 | 12 | 20,0 | 6 | 20,0 | 6 | 20,0 | |
| IIa | T1N1M0 | 34 | 56,7 | 16 | 53,3 | 18 | 60,0 | |
| T2N0M0 | 3 | 5,0 | 2 | 6,7 | 1 | 3,3 | ||
| IIb | T2N1M0 | 11 | 18,3 | 6 | 20 | 5 | 16,7 | |
| Усього | 60 | 100,0 | 30 | 100,0 | 30 | 100,0 | ||
| Оцінка значущості відмінностей між групами | χ2=0,54 р=0,91 | |||||||
Під час аналізу даних, наведених у таблиці 1, треба звернути увагу, що досліджувані групи були порівнянні між собою за складом хворих, і за стадіями їх захворювання (p = 0,91).
В основній досліджуваній групі хворих (n=30), кожен цикл терапії включав двогодинну інфузію лейковорину 200 мг/м2 площі поверхні тіла й одночасно (з використанням У-подібної інфузійної системи) двогодинну інфузію оксаліплатину 85 мг/м2, далі болюсну ін’єкцію фторурацилу 400 мг/м2, і потім – 22-годинну інфузію фторурацилу 600 мг/м2 упродовж двох послідовних днів, кожні 14 днів. Загалом, курс протипухлинного лікування передбачав від 4 до 12 циклів. З початком 2 циклу ад’ювантного лікування, у якості імуномоделюючого агента, пацієнти цієї групи отримували ГМПП за схемою ступінчастої терапії: спочатку ін’єкційно внутрішньом’язово 0,002 г 1 раз на 5 днів (всього – 5 ін’єкцій), а потім по 1 таблетці 2 рази на день сублінґвально упродовж 10 днів. У контрольній групі (n=30), хворим було призначено аналогічний курс ад’ювантної хіміотерапії без застосування ГМПП. Ефективність та безпека досліджуваного пептидного імунокоректора визначалася на підставі оцінки стану хворих, результатів лабораторних тестів, можливого впливу препарату на частоту та інтенсивність проявів побічних ефектів застосовуваної хіміотерапії до початку приймання ГМПП, а також у контрольних точках через 2 тижні та через 6 тижнів після початку застосування препарату.
Для статистичного аналізу результатів дослідження використано методи варіаційної статистики з оцінкою частотних характеристик, середніх величин, середнього квадратичного відхилення. Порівняння показників у динаміці проводилося з використанням критерію Вілкоксону, а оцінка значущості відмінностей між групами – за критерієм Манна-Уітні. Порівняння груп за частотними характеристиками проводилося з використанням критерію Хі-квадрат (χ2) з поправкою Йєтса. Аналіз ймовірності побічних ефектів ад’ювантної хіміотерапії у контрольній та досліджуваній групах пацієнтів проводили методом розрахунку відношення шансів (OR) з оцінкою довірчих інтервалів та рівнів статистичної значущості результатів.
Результати
Вихідні рівні лабораторних показників у досліджуваних групах хворих наведено у таблиці 2.
Таблиця 2
Вихідні лабораторні показники в основній та контрольній групах хворих
|
ПОКАЗНИКИ |
Основна група |
Контрольна група |
Оцінка значущості відмінностей |
|
Х±σ |
Х±σ |
(р) |
|
|
Загальний аналіз крові |
|||
|
Гемоглобін, г/л |
109,3±27,0 |
111,8±23,9 |
0,85 |
|
Еритроцити 1012 /л |
3,2±1,4
|
3,4±1,4 |
0,78 |
|
Лейкоцити 109 /л |
9,3±1,1 |
9,2±2,2 |
0,91 |
|
Нейтрофіли 109 /л |
2,6±0,6 |
2,4±1,1 |
0,66 |
|
Еозинофіли % |
2,5±0,6 |
2,5±0,6 |
0,99 |
|
Нейтрофіли паличкоядерні % |
7,1±1,4 |
6,1±4,1 |
0,53 |
|
Нейтрофіли сегментоядерні % |
44,5±11,3 |
45,6±8,5 |
0,83 |
|
Лімфоцити % |
9,3±6,1 |
9,3±6,1 |
0,99 |
|
Моноцити % |
2,8±0,6 |
2,9±0,8 |
0,78 |
|
ШОЕ мм/год |
37,2±14,6 |
39,4±12,1 |
0,75 |
|
Імунологічні та цитокінові показники |
|||
|
CD3+(Т-лімфоцити) |
2123,6±288,8 |
2200,0±288,8 |
0,61 |
|
CD3+CD(16+56)+(TNK-клітини) |
178,5±121,0 |
169,5±85,3 |
0,87 |
|
CD3 + CD4 + (Т-хелпери) |
1113,0±800,3 |
1200,2±660,0 |
0,82 |
|
CD3+CD8+(T-кілери) |
753,2±272,3 |
753,4±259,9 |
0,98 |
|
CD4+CD8+(дубль-позитивні Т-клітини) |
13,3±5,5 |
12,1±5,5 |
0,67 |
|
CD3-CD8+ (активовані NK-клітини) |
74,6±2,8 |
74,4±2,9 |
0,89 |
|
Співвідношення CD4/CD8 |
0,9±0,3 |
0,9±0,3 |
0,99 |
|
CD3-CD(16+56)+(NK-клітини) |
148,1±57,8 |
144,5±35,8 |
0,88 |
|
CD19+(В-лімфоцити) |
172,3±46,8 |
169,2±30,3 |
0,88 |
|
CD25+(Рецептор ІЛ-2) |
150,6±38,5 |
150,4±38,5 |
0,99 |
|
HLA DR + |
414,9±66,0 |
400,6±57,8 |
0,66 |
|
CD3+HLA DR+ (активовані Т-клітини) |
101,1±24,8 |
102,3±19,3 |
0,92 |
|
CD(16+56)+ HLA DR+ (активовані NK-клітини) |
20,3±8,3 |
20,5±8,3 |
0,96 |
|
CD95+ |
43,4±16,5 |
42,6±22,0 |
0,94 |
|
ІФН-α спонтанна, пг/мл |
15,3±11,0 |
15,1±11,0 |
0,97 |
|
ІФН-α індукована, пг/мл |
123,6±30,3 |
122,2±27,5 |
0,93 |
|
TNFα, пг/мл |
83,4±16,5 |
89,8±11,0 |
0,38 |
Примітка: p – оцінка значущості відмінностей вихідних рівнів показників в основній та контрольній групах за критерієм Манна-Уітні.
Як видно з отриманих результатів, основну та контрольну групи можна порівнювати – відмінності статистично не значущі за всіма лабораторними показниками (p>0,05). Аналіз динаміки досліджуваних показників представлено у таблицях 3 та 4.
Таблиця 3
Лабораторні показники в основній та контрольній групах хворих через 2 тижні лікування
|
ПОКАЗНИКИ |
Основна група |
Контрольна група |
||||
|
Х±σ |
Динаміка 0 – 2 тижні, % |
Оцінка (р) 0 – 2 тижні |
Х±σ |
Динаміка 0 – 2 тижні, % |
Оцінка (р) 0 – 2 тижні |
|
|
Загальний аналіз крові |
||||||
|
Гемоглобін, г/л |
119,1±11,6 |
+9,0 |
0,181 |
109,7±6,1 |
-1,9 |
0,408 |
|
Еритроцити 1012 /л |
3,9±1,1 |
+21,9 |
0,139 |
4,1±0,8 |
+20,6 |
0,117 |
|
Лейкоцити 109 /л |
8,1±1,7 |
-12,9 |
0,051 |
9,1±1,7 |
-1,1 |
0,460 |
|
Нейтрофіли 109 /л |
2,4±0,6 |
-7,7 |
0,241 |
2,2±0,3 |
-8,3 |
0,315 |
|
Еозинофіли % |
2,3±0,3 |
-8,0 |
0,187 |
2,3±0,3 |
-8,0 |
0,187 |
|
Нейтрофіли паличкоядерні % |
6,4±3,9 |
-9,9 |
0,320 |
6,6±2,5 |
+8,2 |
0,388 |
|
Нейтрофіли сегментоядерні % |
52,5±22,8 |
+18,0 |
0,195 |
49,3±19,8 |
+8,1 |
0,319 |
|
Лімфоцити % |
13,3±3,0 |
+43,0 |
0,055 |
13,3±3,0 |
+43,0 |
0,055 |
|
Моноцити % |
3,1±0,3 |
+10,7 |
0,092 |
3,1±0,3 |
+6,9 |
0,265 |
|
ШОЕ мм/год |
33,8±17,6 |
-9,1 |
0,342 |
33,8±17,6 |
-14,2 |
0,237 |
|
Імунологічні та цитокінові показники |
||||||
|
CD3+(Т-лімфоцити) |
2356,3±338,3 |
+11,0 |
0,078 |
2130±577,5 |
-3,2 |
0,383 |
|
CD3+CD(16+56)+(TNK-клітини) |
194,2±79,8 |
+8,8 |
0,383 |
190,2±57,8 |
+12,2 |
0,291 |
|
CD3 + CD4 + (Т-хелпери) |
1236,5±517,0 |
+11,1 |
0,361 |
1363,5±522,5 |
+13,6 |
0,298 |
|
CD3+CD8+(T-кілери) |
821,2±203,5 |
+9,0 |
0,292 |
741,6±165,0 |
-1,6 |
0,460 |
|
CD4+CD8+(дубль-позитивні Т-клітини) |
14,3±2,8 |
+7,5 |
0,328 |
13,1±5,5 |
+8,3 |
0,362 |
|
CD3-CD8+ (активовані NK-клітини) |
82,2±8,3 |
+10,2 |
0,010 |
82,6±8,3 |
+11,0 |
0,006 |
|
Співвідношення CD4/CD8 |
1,0±0,6 |
+11,1 |
0,328 |
1,0±0,6 |
+11,1 |
0,328 |
|
CD3-CD(16+56)+(NK-клітини) |
183,6±74,3 |
+24,0 |
0,152 |
182,6±46,8 |
+26,4 |
0,040 |
|
CD19+(В-лімфоцити) |
188,1±85,3 |
+9,2 |
0,328 |
177,5±57,8 |
+4,9 |
0,364 |
|
CD25+(Рецептор ІЛ-2) |
166,2±33,0 |
+10,4 |
0,200 |
166,2±33,0 |
+10,5 |
0,197 |
|
HLA DR + |
451,5±57,8 |
+8,8 |
0,128 |
440,3±79,8 |
+9,9 |
0,136 |
|
CD3+ HLA DR+ (активовані Т-клітини) |
112,3±38,5 |
+11,1 |
0,252 |
108,9±16,5 |
+6,5 |
0,238 |
|
CD(16+56)+ HLA DR+ (активовані NK-клітини) |
17,2±2,8 |
-15,3 |
0,165 |
17,7±2,8 |
-13,7 |
0,190 |
|
CD95+ |
44,8±13,8 |
+3,2 |
0,429 |
46,1±13,8 |
+8,2 |
0,356 |
|
ІФН- α спонтанна, пг/мл |
17,6±2,8 |
+15,0 |
0,290 |
17,2±2,8 |
+13,9 |
0,306 |
|
ІФН- α індукована, пг/мл |
137,5±24,8 |
+11,2 |
0,166 |
139,8±30,3 |
+14,4 |
0,121 |
|
TNF α, пг/мл |
56,3±11,0 |
-32,5 |
0,001 |
55,6±11,0 |
-38,1 |
0,00 |
Примітка: р – оцінка значущості відмінностей показників через 2 тижні щодо вихідного рівня (критерій Уілкоксона).
Через 2 тижні після початку лікування відзначається підвищення рівня більшості імунологічних та цитокінових показників. Позитивна динаміка змін за вказаний період статистично не значуща практично за всіма показниками та є порівнюваною в основній та контрольній групах. Статистично значуще підвищення (p<0,01) виявляється тільки для показника CD3-CD8+ (активовані NK-клітини) – +10,2% в основній, та +11,0% у контрольній групах. Істотне зниження відбувається за показником TNFα: на -32,5% в основній та -38,1% у контрольній групі (p<0,01). За іншими імунологічними показниками динаміка приросту менш виражена, або статистично не значуща через високу варіабельність показників у групах порівняння.
Під час лікування, пацієнти основної досліджуваної групи суб’єктивно зазначали відчутне поліпшення свого загального стану, а під час проходження контрольних точок, ми зафіксували тенденцію до нормалізації гематологічних показників, а також стабільного зростання кількості активних імунокомпетентних клітин від 2 до 6 тижня застосування ГМПП.
Таблиця 4
Лабораторні показники в основній та контрольній групах хворих через 6 тижнів
|
ПОКАЗНИКИ |
Основна група |
Контрольна група |
||||
|
Х±σ |
Динаміка 0 – 6 тижнів, % |
Оцінка (р) 0 – 6 тижнів |
Х±σ |
Динаміка 0 – 6 тижнів, % |
Оцінка (р) 0 – 6 тижнів |
|
|
Загальний аналіз крові |
||||||
|
Гемоглобін, г/л |
123,5±15,4 |
+13,0 |
0,107 |
123,5±12,7 |
+10,5 |
0,120 |
|
Еритроцити 1012 /л |
4,2±0,8 |
+31,3 |
0,046 |
4,3±0,8 |
+26,5 |
0,064 |
|
Лейкоцити 109 /л |
8,0±2,5 |
-14,0 |
0,096 |
8,1±2,5 |
-12,0 |
0,182 |
|
Нейтрофіли 109 /л |
2,8±0,3 |
+7,7 |
0,187 |
1,8±0,3 |
-25,0 |
0,075 |
|
Еозинофіли % |
1,9±3,6 |
-24,0 |
0,325 |
1,9±3,6 |
-24,0 |
0,325 |
|
Нейтрофіли паличкоядерні % |
5,8±1,4 |
-18,3 |
0,036 |
5,5±1,4 |
-9,8 |
0,353 |
|
Нейтрофіли сегментоядерні % |
60,1±10,7 |
+35,1 |
0,004 |
51,9±11,0 |
+13,8 |
0,109 |
|
Лімфоцити % |
19,9±6,6 |
+114,0 |
0,001 |
19,8±6,2 |
+113,0 |
0,001 |
|
Моноцити % |
5,2±1,7 |
+85,7 |
0,000 |
5,2±1,7 |
+79,3 |
0,001 |
|
ШОЕ мм/год |
31,1±13,5 |
-16,4 |
0,201 |
29,1±5,0 |
-26,1 |
0,017 |
|
Імунологічні та цитокінові показники |
||||||
|
CD3+(Т-лімфоцити) |
2458,1±327,3 |
+15,8 |
0,020 |
2190,0±302,5 |
-0,5 |
0,474 |
|
CD3+CD(16+56)+(TNK-клітини) |
259,3±41,3 |
+45,3 |
0,044 |
266,5±30,3 |
+57,2 |
0,002 |
|
CD3 + CD4 + (Т-хелпери) |
1342,7±404,3 |
+20,6 |
0,242 |
1390±550,0 |
+15,8 |
0,273 |
|
CD3+CD8+(T-кілери) |
1092,6±242,0 |
+45,1 |
0,006 |
870,4±148,5 |
+15,5 |
0,152 |
|
CD4+CD8+(дубль-позитивні Т-клітини) |
19,2±5,5 |
+44,4 |
0,021 |
19,2±5,5 |
+58,7 |
0,007 |
|
CD3-CD8+ (активовані NK-клітини) |
90,4±2,8 |
+21,2 |
0,001 |
90,3±2,8 |
+21,4 |
0,001 |
|
Співвідношення CD4/CD8 |
1,2±0,3 |
+33,3 |
0,019 |
1,0±0,3 |
+11,1 |
0,241 |
|
CD3-CD(16+56)+(NK-клітини) |
250,3±44,0 |
+69,0 |
0,001 |
223,1±24,8 |
+54,4 |
0,001 |
|
CD19+(В-лімфоцити) |
244,6±52,3 |
+42,0 |
0,003 |
211,5±52,3 |
+25,0 |
0,029 |
|
CD25+(Рецептор ІЛ-2) |
218,8±35,8 |
+45,3 |
0,001 |
218,2±35,8 |
+45,1 |
0,001 |
|
HLA DR + |
499,1±79,8 |
+20,3 |
0,015 |
479,4±74,3 |
+19,7 |
0,012 |
|
CD3+ HLA DR+ (активовані Т-клітини) |
122,7±24,8 |
+21,4 |
0,047 |
110,2±8,3 |
+7,7 |
0,152 |
|
CD(16+56)+ HLA DR+ (активовані NK-клітини) |
29,5±5,4 |
+45,3 |
0,007 |
24,1±8,2 |
+17,6 |
0,200 |
|
CD95+ |
55,3±5,7 |
+27,4 |
0,032 |
54,1±8,5 |
+27,0 |
0,092 |
|
ІФН- α спонтанна, пг/мл |
19,2±5,3 |
+25,5 |
0,193 |
17,1±5,5 |
+13,2 |
0,328 |
|
ІФН- α індукована, пг/мл |
149,4±13,8 |
+20,9 |
0,018 |
151,3±18,5 |
+23,8 |
0,003 |
|
TNF α, пг/мл |
72,1±16,5 |
-13,5 |
0,094 |
59,4±11,0 |
-33,9 |
0,001 |
Примітка: p – оцінка значущості відмінностей показників через 6 тижнів щодо вихідного рівня (критерій Уілкоксона).
Через 6 тижнів ми можемо зазначити суттєвий статистично значущий (p<0,05) приріст практично всіх імунологічних показників у основній групі від +15,8% до 69,0%. Найбільш значуще підвищення рівня показників в основній групі відмічається з боку CD3-CD(16+56)+(NK-клітини) – з 148,1±57,8 до 250,3±44,0 (p=0,001); CD19+(В-лімфоцити) – з 188,1±85,3 до 244,6±52,3 (p=0,003); CD25+(Рецептор ІЛ-2) з 150,6±38,5 до 218,8±35,8 (p=0,001); CD3+CD8+(T-кілери) з 753,2±272,3 до 1092,6±242,0 (p=0,006); CD3+CD(16+56)+(TNK-клітини) з 178,5±121,0 до 259,3±41,3 (p=0,044); CD95+ з 43,4±16,5 до 55,3±5,7 (p=0,032). Індекс CD4/CD8 у цих хворих, у середньому, зріс від 0,9 на початку лікування, до 1,2 на 6 тижні лікування. У контрольній групі також відзначається підвищення лабораторних показників функції імунної системи та цитокінового профілю, проте зазначена динаміка була менш вираженою. Для більшості показників характерною є не лише оптимізація їхнього рівня, а й зниження варіабельності в досліджуваних групах до 6-го тижня спостереження.
Серед лабораторних параметрів загального аналізу крові, найбільш суттєва позитивна динаміка відзначається за рівнем лімфоцитів, моноцитів, сегментоядерних нейтрофілів, еритроцитів. Зниження рівня показників за 6-ти тижневий період спостереження відмічається щодо ШОЕ, еозинофілів, паличкоядерних нейтрофілів.
Різноспрямована динаміка (підвищення в основній групі та зниження в контрольній) зазначається щодо наступних показників: нейтрофіли – +7,7% в основній та -25,0% в контрольній; CD3+(Т-лімфоцити) – +15,8% в основній та -0,5% у контрольній.
Зниження рівня показника в цілому, характерне для TNFa в обох групах, але було більш вираженим у контрольній групі (-13,5% та -33,9% відповідно). При цьому, на 2 тижні було відзначено помітне зниження його концентрації (-32,5% в основній та -38,1% у контрольній), що, мабуть, пов’язане з реакцією на проведення хімієтерапії. Однак до 6-го тижня, після переходу з ін’єкційної на сублінґвальну форму препарату ГМПП, концентрація TNFα у пацієнтів помітно зросла до середніх значень 72,1±16,5 пг/мл, але при цьому практично не змінилася в контрольній групі.
Обговорення
Узагальнена характеристика контрольної групи хворих на тлі ад’ювантної хімієтерапії без застосування імуномодулювального препарату мурамілпептидного ряду, дає змогу зробити висновок про поступову нормалізацію гематологічних та імунологічних показників (таблиця 4). Однак на тлі нормалізації рівня гемоглобіну, збільшення кількості еритроцитів та лейкоцитів, зберігався відносно низький рівень нейтрофілів. Ми зазначили, що рівень активованих Т-кілерів та NK-клітин загалом повторював тенденції референтної групи, проте нормалізація показника CD4/CD8 відбувалася повільніше, а рівень інтерферону та TNF α практично не зростав. Порівняльну оцінку динаміки деяких імунологічних показників наведено на малюнку 1.
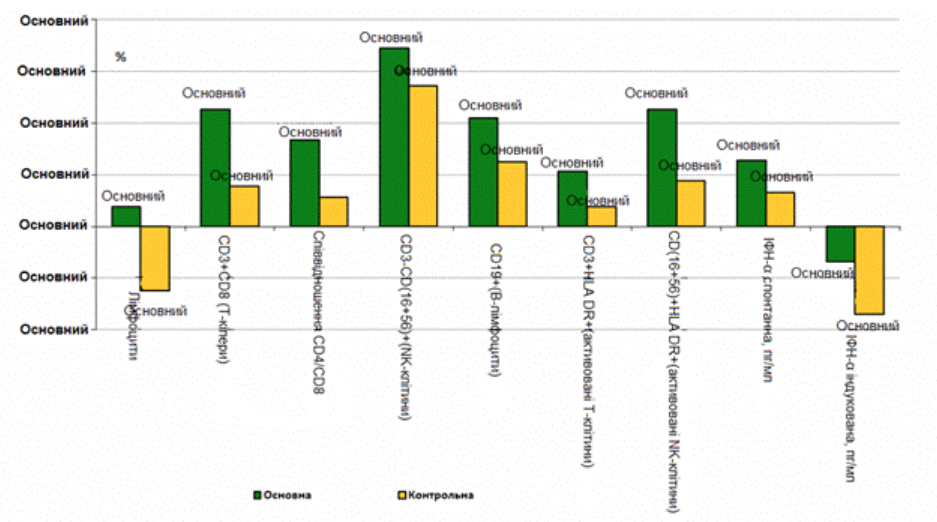
Мал. 1 Порівняльна динаміка ключових лабораторних показників у досліджуваних групах через 6 тижнів (%).
Найбільш суттєві відмінності по динаміці показників характерні для рівня нейтрофілів (відмінності між групами складають 32,7%), CD3+CD8+ (T-кілери) (відмінності складають 29,6%), співвідношення CD4+/CD8+ (відмінності 22,2%), CD (16+56)+HLA DR+(активовані NK-клітини) (міжгрупові відмінності 27,7%).
Під час аналізу випадків можливих побічних ефектів цитостатичної терапії, ми спостерігали, що в контрольній групі у більшої кількості хворих ці явища були присутні як на другому, так і на четвертому циклі ад’ювантної хімієтерапії: діарея зберігалася у 2 (6,6%) пацієнтів, блювання у 7 (23,3%), астенія у 12 (40,0%), головний біль у 11 (36,6%), периферична нейропатія виникла у 2 (6,6%) хворих. В основній групі, всі ці побічні реакції також були присутні, проте до 6 тижня частота їх виявлення була суттєво нижчою: діарея була у 1 (3,3%) пацієнта, блювання у 3 (10,0%), астенія у 5 (16,6%), головний біль у 4 (13,3%), периферична нейропатія виникла у 1 (3,3%) пацієнта. Порівняльну оцінку шансів виявлення побічних ефектів у пацієнтів контрольної та основної груп наведено у таблиці 5.
Таблиця 5
Оцінка ймовірності виявлення побічних ефектів ад’ювантної хіміотерапії у контрольній групі, у порівнянні з основною на 6 тижні.
| Побічні ефекти | Відношення шансів АБО (CI) | Оцінка р |
| Периферична нейропатія | 2,1 (0,18 – 24,1) | р = 0,55 |
| Головний біль | 3,7 (1,04 – 13,6) | р = 0,034 |
| Астенія | 3,3 (1,02 – 11,1) | р = 0,044 |
| Блювання | 2,7 (0,6 – 11,8) | р = 0,16 |
Примітка: OR (CI) – відношення шансів та довірчий інтервал.
За частотою побічних явищ, у ранньому періоді спостереження (2 тижні) не вдалося виявити суттєвих відмінностей. Однак до 6-го тижня лікування, ймовірність виникнення побічних явищ у контрольній групі перевищує аналогічні шанси у пацієнтів основної групи з усіх їх можливих видів з найбільш значущими відмінностями щодо частоти виявлення головного болю (p=0,034) та астенії (p=0,044).
На тлі нейтропенії, у 1 пацієнтки контрольної групи виникло загострення хронічного пієлонефриту з розвитком лейкоцитурії, підвищенням температури тіла до 38,3 0 С, погіршенням загального стану. Для лікування цього ускладнення було призначено цефоперазон/сульбактам, що дало змогу протягом 7 днів домогтися ремісії хронічного пієлонефриту. У 1 пацієнта після 3 циклу ад’ювантної хіміотерапії діагностували кандидоз слизової оболонки рота, через що йому довелося призначити флуконазол.
Висновок
Після аналізу отриманих результатів можна стверджувати, що додавання імуномодулювального препарату мурамілпептидного ряду до курсу ад’ювантної хіміотерапії пацієнтів, прооперованих з приводу КРР, супроводжується помітним поліпшенням гематологічних та імунологічних показників, сприяє активації протипухлинного імунітету, що може стати підґрунтям для профілактики метастазів раку. Препарат продемонстрував здатність запобігати розвитку нейтропенії під час застосування цитостатиків, а також позитивний вплив на імунокомпетентні клітини, котрі відіграють ключову роль у захисті організму від ймовірної інфекції.
Найбільш важливим, на наш погляд, терапевтичним ефектом імуномодулюючого препарату мурамілпептидного ряду, є його комплексний антитоксичний та органопротекторний ефект на тлі хімієтерапії. Можна обґрунтовано стверджувати, що препарат має потужний регуляторний потенціал, запускаючи механізми захисту органів й тканин від токсичних агентів та відновлюючи порушені метаболічні процеси. В основній (досліджуваній) групі пацієнтів, частота прояву таких поширених побічних реакцій хіміотерапії як блювання, головний біль, астенія та периферична нейропатія була нижчою, ніж серед хворих контрольної групи.
Підсумки цієї роботи дають нам змогу позитивно оцінити природний вітчизняний імуномоделюючий засіб мурамілпептидного ряду та рекомендувати його у якості препарату супроводу у схемах комплексної терапії пацієнтів з колоректальним раком.
ЛІТЕРАТУРА
- Рак в Україні, 2007–2008 (2009). Бюл. національного канцер-реєстру України №10. – Київ, 104 с.
- Мартынюк В.В. (2004). Рак толстой кишки (заболеваемость, смертность, факторы риска, скрининг) // Практическая онкология: избранные лекции. – СПб., С. 151–161.
- Переводчикова Н.И. (2004). Химиотерапия метастатического колоректального рака //Практическая онкология: избранные лекции. – СПб., С. 230–244.
- Пророков В.В., Малихов А.Г., Кныш В.И. (2004). Современныепринципы диагностики и скрининга рака прямой кишки //Практическая онкология: избранные лекции. – СПб., С. 162–167.
- Царьков П.В.,Воробьев Г.И., Одарюк Т.С. (2004). Место и роль расширенной аорто–подвздошно–тазовой лимфаденэктомии в лечении рака нижнеампулярного отдела прямой кишки // Практическая онкология: избранные лекции. – СПб., С. 168–180.
- Bertario L. (1999). Reducing colorectal cancer mortality by repeated faecal occult blood test a nested case–control study // Eur. J. Cancer. V. 35. P. 973–977.
- Billingham B.P. (1994). Extended lymphadenectomy for rectal cancer: cure vs quality of life // Int. Surg. V. 79. №1. P. 11–22.
- Schrag D., Weeks J. (1999). Costs and cost–effectiveness of colorectal cancer prevention and therapy //Semin. Oncol. V. 26. P. 561–568.
- Takahashi T., Veno M., Azekura K., Ota H. (1997). The lymphatic spread of rectal cancer and effect of dissection: Japanese contribution and experience // Soreide O., Norstein J. Rectal cancersurgery. – Berlin, Heidelberg: Springer–Verlag, P. 164–180.
- Garth A.K., Newsome C.M., Simmance N. et al. (2010). Nutritional status, nutrition practices and post-operative complications in patients with gastrointestinal cancer // J. Hum. Nutr. Diet. V. 23. Р. 393–401.
- Jeffery K.M., Harkins B., Cresci G.A. et al. (1996). The clear liquid diet is no longer a necessity in the routine postoperative management of surgical patients //Am. Surg. V .62. Р. 167–170.
РЕЗЮМЕ
ДОСВІД ЗАСТОСУВАННЯ ІМУНОМОДУЛЮЮЧОГО ПРЕПАРАТУ МУРАМІЛПЕПТИДНОГО РЯДУ В КОМПЛЕКСНІЙ ТЕРАПІЇ ХВОРИХ НА КОЛОРЕКТАЛЬНИЙ РАК
Є.С.Готько (рос.)
Кафедра клінічної онкології та променевих методів діагностики Ужгородського національного університету (Ужгород, Україна)
Мета дослідження – вивчення ефективності і безпечності ад’ювантної схеми терапії хворих на колоректальний рак з використанням імуномодулюючого препарату мурамілпептидного ряду. Методи дослідження – клінічні, імунологічні, статистичні. В дослідження були включені 60 пацієнтів у віці від 46 до 69 років з різними стадіями колоректального раку і з різним об’ємом оперативного втручання. Приєднання імуномодулюючого препарату мурамілпептидного ряду до схеми ад’ювантної терапії пацієнтів, прооперованих з приводу колоректального раку, призводить до помітного покращення гематологічних та імунологічних показників, сприяє активації протипухлинного імунітету. Препарат продемонстрував здатність попереджати розвиток нейтропенії в ході використання цитостатиків, позитивний вплив на імунокомпетентні клітини, а також комплексну антитоксичну та органопротекторну дію. Він може бути рекомендований в якості препарату супроводу в схемах комплексної терапії пацієнтів з колоректальним раком.
Ключові слова: колоректальний рак, ад’ювантна терапія, імуномодулятор мурамілпептидного ряду.
РЕЗЮМЕ
ОПЫТ ПРИМЕНЕНИЯ ИММУНОМОДУЛИРУЮЩЕГО ПРЕПАРАТА МУРАМИЛПЕПТИДНОГО РЯДА В КОМПЛЕКСНОЙ ТЕРАПИИ БОЛЬНЫХ КОЛОРЕКТАЛЬНЫМ РАКОМ
Е.С.Готько (рус.)
Кафедра клинической онкологии и лучевых методов диагностики Ужгородского национального университета (Ужгород, Украина)
Цель исследования – изучение эффективности и безопасности адъювантной схемы терапии больных колоректальным раком с применением иммуномодулирующего препарата мурамилпептидного ряда. Методы исследования – клинические, иммунологические, статистические. В исследование были включены 60 пациентов в возрасте от 46 до 69 лет с различными стадиями колоректального рака и с разным объемом оперативного вмешательства. Присоединение иммуномодулирующего препарата мурамилпептидного ряда к схеме адъювантной терапии пациентов, прооперированных по поводу колоректального рака, приводит к заметному улучшению гематологических и иммунологических показателей, способствует активации противоопухолевого иммунитета. Препарат продемонстрировал способность предотвращать развитие нейтропении в ходе применения цитостатиков, позитивное воздействие на иммунокомпетентные клетки, а также комплексное антитоксическое и органопротекторное действие. Он может быть рекомендован в качестве препарата сопровождения в схемах комплексной терапии пациентов с колоректальным раком.
Ключевые слова: колоректальный рак, адъювантная химиотерапия, иммуномодулятор мурамилпептидного ряда.
The experience of application of the immunomodulating preparation of muramilpeptide range in complex therapy of patients with colorectal cancer
E.S. Got’ko (rus)
The department of clinical oncology and radio methods diagnostics of Uzhgorod National University (Uzhgorod, Ukraine)
Research objective – the study of efficiency and safety of adjuvant scheme of chemotherapy of patients with colorectal cancer with the application of immunomodulating preparation of muramilpeptide range. Research methods – clinical, immunological, statistic. The study included 60 patients in the age from 46 to 69 with the various stages of colorectal cancer with different extent of surgical procedure. The use of the immunomodulating preparation of muramilpeptide range in the scheme of the adjuvant chemotherapy of patients operated on colorectal cancer results in the better hematologic and immunologic indexes, promotes the activation of antitumoral immunity. The preparation showed the ability to prevent the development of granulopenia when using cytostatics, the positive influence on immunocompetent cells and also the complex antitoxic and organoprotective action. It can be recommended as the preparation of maintenance in the schemes of complex therapy of patients with colorectal cancer.
Key words: colorectal cancer, adjuvant therapy, immunomodulator of muramilpeptide range
Share the post "ДОСВІД ЗАСТОСУВАННЯ ІМУНОМОДУЛЮЮЧОГО ПЕПТИДНОГО ПРЕПАРАТУ ЛІАСТЕН У КОМПЛЕКСНІЙ ТЕРАПІЇ ХВОРИХ НА КОЛОРЕКТАЛЬНИЙ РАК"


