А.А. Суханова, Н.Я. Ратушняк, О.О. Сорокіна
Український державний інститут репродуктології Національної медичної академії післядипломної освіти імені П.Л. Шупика, м. Київ
У статті висвітлено сучасний погляд на процес утворення, лікування та профілактики перитонеальних тазових спайок. Відомо, що спайкова хвороба збільшує ризик виникнення кишкової непрохідності, безплідності, хронічного тазового болю та хірургічних ускладнень, тому метою даного дослідження є створення алгоритму профілактики виникнення спайкової хвороби у пацієнток у ранній післяопераційний період.
Ключові слова: тазові спайки, гінекологія, хірургія, лапаротомія, лапароскопія.
Спайкова хвороба малого таза – проблема оперативної гінекології, яка відома лікарям з часів Гіппократа. Перші описи спайкового процесу датуються XVI століттям (Vesarius A De Corporis Humani Fabrica In., 1543). Згадування спайкової хвороби у документальних матеріалах починається з публікації Hunter (1793).
Проблема спайкової хвороби до сьогодні є актуальною. Згідно з класифікацією ВООЗ, яка прийнята в 1990 році в Женеві Всесвітньою Асамблеєю Охорони Здоров’я (Міжнародна класифікація хвороб 10-го перегляду), тазові спайки у жінок виділені в окремий розділ.
Основними чинниками, які зумовлюють утворювання спайок у малому тазі є операції на органах черевної порожнини та малого таза (лапаротомія, лапароскопія), запальні захворювання придатків матки та зовнішній генітальний ендометріоз.
За даними дослідження SURGERY AND CLINICAL ADHESIONS RESEARCH у Швейцарії: у 30% пацієнтів, що перенесли операції на органах черевної порожнини та малого таза, протягом 10 років з’являються клінічні прояви спайок, з них протягом першого року госпіталізують 20% пацієнтів, серед яких 4,5% – щодо тонкокишкової непрохідності. Найбільш часто спайки, що потребують госпіталізації, виникають після оперативних втручань в абдомінальній хірургії та гінекології.
Невирішеними залишаються питання патогенезу, профілактики та лікування спайкового процесу. Відомо, що пусковими механізмами в утворенні спайок є такі фактори:
- механічний – травмування очеревини під час розсічен-ня, захоплення інструментами, промокання та протирання сухими марлевими серветками, висічення ділянок очеревини під час хірургічного втручання;
- фізичний – висушування очеревини повітрям, дія високої температури (опіки) при застосуванні під час операції електроножа, лазерного випромінювання, гарячих розчинів;
- інфекційний – проникнення інфекції у черевну порож-нину ендогенним (запальний процес органу черевної порожнини з розвитком місцевого і загального запалення очеревини) та екзогенним (при пораненні, перфорації порожнистого органу) шляхами;
- імплантаційний – асептичне запалення очеревини вна-слідок залишення у черевній порожнині тампонів, дренажних трубок, шовного матеріалу, який не розсмоктується або довго розсмоктується, шматочків марлі, тальку з рукавичок, крововиливів і гематом очеревини;
- хімічний – потрапляння під час операції у черевну по-рожнину речовин, які зумовлюють хімічний опік та асептичне запалення очеревини (йод, спирт, концентровані розчини антибіотиків тощо).
Формування спайок – це порушення балансу між ангіогенними, фібриногенними та фібринолітичними факторами.
Незважаючи на різноманітність причин, які зумовлюють спайковий процес у малому тазі, основні пошуки спрямовані на вивчення етіології та профілактики саме післяопераційних тазових спайок.
За результатами експериментальних досліджень, при пошкодженні очеревини можна виділити 5 фаз адгезіогенезу:
- Реактивна фаза (перші 12 год) клінічно та морфологічно проявляється ознаками шоку, визначається пошкодження очеревини.
- Фаза ексудації (1–3-я доба). Процеси ексудації переважають над іншими процесами запалення. Підвищується проникність судинного русла, що зумовлює вихід у вільну черевну порожнину перитонеальних малодиференційованих поліпотентних клітин, клітин запалення і рідкої частини крові, яка містить фібриноген.
- Фаза адгезії (3-я доба). Випадіння фібрину на пошкоджених поверхнях, їхнє склеювання. Поліпотентні клітини очеревинного ексудату диференціюються у фібробласти, які продукують колаген.
- Фаза молодих зрощень (7–14-а доба). Утворюються пухкі спайки, які містять недостатню кількість колагену. У спайках відбувається новоутворення судин і міграція гладком’язових клітин.
Лікування спайкової хвороби здійснюють консервативним або оперативним методами. Показаннями до операції є гострий напад спайкової непрохідності кишечнику, рецидивуючий перебіг спайкової хвороби. У гінекології основним хірургічним методом лікування спайкової хвороби є лапароскопічний адгезіолізис.
На сьогодні запропоновано багато технічних прийомів і препаратів, які попереджують утворення післяопераційних спайок. Основні підходи щодо профілактики спайкової хвороби полягають у:
- своєчасному оперативному втручанні;
- промиванні черевної порожнини;
- антибіотикотерапії;
- вживанні антикоагулянтів;
- стимуляції моторики кишечнику;
- використанні протеолітичних та фібринолітичних ферментів;
- оснащенні інсуфлятора кондиціонером.
Мета дослідження: профілактика утворення спайок у хворих у післяопераційний період.
МАТЕРІАЛИ ТА МЕТОДИ
Дослідження виконано на базі КМЦРПМ з січня 2017 до червня 2018 року.
Мал. 1. Розподілення хворих зі спайковою хворобою залежно від виду та показань до оперативного втручання.
Дослідження проводили у два етапи.
На першому етапі був проведений ретроспективний аналіз амбулаторних карт 1500 пацієнток віком від 20 до 65 років, яким виконували оперативне лікування гінекологічних захворювань лапаротомічним та лапароскопічним оперативними доступами.
Серед пацієнток, у яких був інтраопераційно виявлений спайковий процес органів малого таза (ОМТ), проаналізовано клініко-анамнестичні дані. Особливу увагу звертали на наявність генітального ендометріозу, повторні оперативні втручання та хронічний запальний процес.
На другому етапі пацієнток розподілили на дві групи: І група (основна) та ІІ група (контрольна).
До І групи (основної) були включені 86 пацієнток у післяопераційний період, які отримували стандартну схему лікування та препарати Тіотриазоліну по 1 супозиторію ректально з 1-го дня після операції протягом 14 днів (кінець фази молодих зрощень у процесі утворення спайок).
До ІІ групи (контрольної) були включені 73 пацієнтки у післяопераційний період, які отримували стандартну схему лікування.
Протизапальний ефект, як результат інгібування перекисного окислення ліпідів в травмованих тканинах, дозволяє посилити дію НПВС та швидше позбутися больового синдрому.
Таке скорочення періоду запалення, значним чином відбувається за рахунок зменшення тривалості фази альтерації, першого етапу запалення, яким, головним чином, і обумовлюються подальші наслідки процесу.
Також привертають увагу м’які фібринолітичні властивості тіотриазоліну, котрі найкраще реалізуються в умовах оксидантного стресу пошкоджених втручанням тканин за рахунок зусиль компенсаторної активації анаеробного гліколізу і активації процесів окиснення в циклі Кребса зі збереженням внутрішньоклітинного фонду АТФ.
Тіотриазолін, особливо в умовах ішемічної патології, проявляє помірну фібринолітичну активність та сприяє підвищенню активності фібринолізу. При цьому, прямого фібринолітичного впливу, препарат не чинить, основний ефект реалізується завдяки вираженій антиоксидантній дії, а саме – зв‘язуванні Активних форм кисню (АФК) та модуляцією експресії тканинного плазміногену. Таким чином, тіотриазолін проявляє помірні фібринолітичні властивості саме при настанні патологічних явищ, на фоні активації оксидантного стресу. На відміну від класичних фібринолітиків та антикоагулянтів, тіотриазолін не здатен спричинити кровотечу або антигенобумовлений тромбоз. Повну безпеку тіотриазоліну стосовно гемостазу, підтверджено численними клінічними дослідженнями у вітчизняних та закордонних закладах. У жодному з них не було зареєстровано випадків поісляопераційної кровотечі або настання некомпетентності швів.
Цим тіотриазолін фундаментально відрізняється від препаратів протеолітичних ферментів (стрептокіназа, стрептодорназа), котрі розчиняють будьякі відкладення фібрину і тому, через ризик кровотечі із залучених до операції ділянок тіла, не можуть застосовуватися першими днями. Натомість, призначення «Далмаксину» з першої доби після операції, мінімізує прояви найбільш важливих у розвитку спайок фаз: реактивної та ексудативної.
Під впливом тіотриазоліну, руйнується основний чинник запалення, а саме – перехід клітинного обміну в умовах ішемії до альтернативного, анаеробного механізму. За дефіциту активного кисню, в клітинах накопичуються продукти анаеробного гліколізу (лактат) та зміщується рН в сторону закислення. Як наслідок, підвищується проникність клітинних мембран, що може призвести до руйнування клітини.
Протиішемічна та протизапальна дії тіотриазоліну полягають в збереженні та збільшенні внутрішньоклітинних запасів АТФ. Як наслідок, метаболізм повертається до продуктивного аеробного механізму, нормалізується pH. А вже за рахунок цього, значно зменшується масивність пропотівання фібриногену та поліпотентних клітин до черевної порожнини, значить зникає саме підґрунтя для утворення спайок очеревини та розвитку спайкової хвороби надалі.
Таким чином, тіотриазолін зменшує ризик метаболічного ацидозу, нормалізує pH та забезпечує зниження експресії ключових факторів розвитку спайкового процесу.
РЕЗУЛЬТАТИ ДОСЛІДЖЕННЯ ТА ЇХ ОБГОВОРЕННЯ
На першому етапі дослідження було виявлено, що із 1500 пацієнток у 1230 (82%) наявна спайкова хвороба, відповідно у 270 (18%) пацієнток спайковий процес був відсутній.
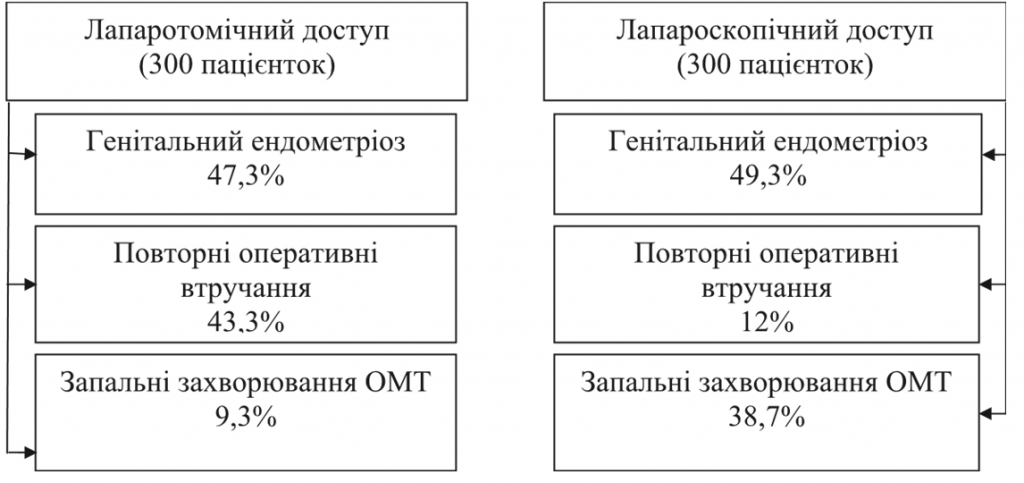
Пацієнтки, у яких була виявлена спайкова хвороба (600 осіб), були розподілені на дві групи залежно від виду оперативного втручання. Метою цього аналізу було виявлення основних етіологічних факторів розвитку спайкового процесу ОМТ та визначення впливу виду оперативного втручання (малюнок).
Згідно з отриманими даними, генітальний ендометріоз – це основний етіологічний фактор спайкового процесу ОМТ у 47,3% при лапаратомічному виді втручання та у 49,3% – при лапароскопічному. Кількість повторних оперативних втручань в анамнезі переважає у групі пацієнток з лапаротомічним доступом – 43,3%, при лапароскопії повторні втручання були у 12%. Але, враховуючи дані багатьох досліджень, зроблений висновок, що лапароскопічна хірургія незначно знижує поширеність та ступінь залучення кишківника у спайковий процес. Можливо, знижує поширеність спайок безпосередньо у зоні оперативного втручання та не приводить до профілактики спайок, оскільки не зменшує спайкоутворення у контексті патогенезу цього процесу. Отже, лапароскопічна хірургія практично не знижує частоти поширеності спайкового процесу.
Таблиця 1. Результати лікування хворих І та ІІ груп у післяопераційний період.
| Показник | І група, n=86 | ІІ група, n=73 | р |
| Період гіперемії, днів | 0,91±0,22 | 2,71±0,57 | 0,008 |
| Кількість пацієнтів з гіпертермією більше 3 діб, n (%) | 6 (6,9) | 14 (19,2) | 0,047 |
| Середній час перебування у стаціонарі після операції, днів | 2,2±1,1 | 3,3±0,7 | 0,002 |
Запальні захворювання ОМТ в анамнезі переважають у групі з лапароскопічним доступом – 38,7%, при лапаратомії 9,3%.
На другому етапі дослідження визначали перебіг післяопераційного періоду у пацієнток, які були розподілені на дві групи. До І групи (основної) увійшли 86 жінок, що отримували стандартну схему лікування, яка передбачала використання антибактеріальної, протизапальної, знеболювальної та симптоматичної терапії і тіотриазолін (Далмаксін) по 1 супозиторію ректально 1 раз на добу протягом 14 днів до закінчення фази молодих зрощень. До ІІ групи (контрольної) увійшли 73 жінки, яким була призначена стандартна схема лікування у післяопераційний період.
Згідно з отриманими результатами, що відображені у таблиці, період гіперемії у ІІ групі тривав у 2 рази більше часу, ніж у І групі. Також ІІ група переважає за кількістю пацієнтів з гіпертермією більше 3 діб – 14 (19,2%) порівняно з І групою – 6 (6,9%) пацієнток. За часом перебування в стаціонарі переважає ІІ група (контрольна) – 3,3%, що отримувала стандартну схему лікування у післяопераційний період порівняно з І групою (основною) – 2,2%.
Перебіг раннього післяопераційного періоду оцінювали за виразністю больового синдрому за десятибальною шкалою, наявністю ускладнень.
Оперовані пацієнтки з І групи (основної) оцінювали післяопераційний больовий синдром у середньому у 3,1 бали (p=0,00), з ІІ групи (контрольної) – у 3,4 бали (p=0,06).
Для знеболювання використовували синтетичні опіоїдні аналгетики та нестероїдні протизапальні засоби, які вводили внутрішньом’язово.
Оперованим з ІІ групи знадобилась більша кількість ін’єкцій препаратів обох груп у розрахунку на одну хвору (5±3 і 6±1, 9±5 і 14±4 відповідно). Різниця була статистично достовірною (р=0,009 та р=0,006).
ВИСНОВКИ
Спайкова хвороба справляє негативний вплив на стан здоров’я хворих, збільшуючи ризик виникнення кишкової непрохідності, безплідності, хронічного тазового болю та хірургічних ускладнень, пов’язаних з інтраопераційним травмуванням внутрішніх органів.
Необхідно своєчасно виділити серед пацієнтів групу ризику з розвитку спайкового процесу у післяопераційний період.
Ранній початок профілактики спайкового процесу із застосуванням тіатриазоліну (Далмаксіну) у доповнення до стандартної схеми лікування етіопатогенетично обґрунтовано, покращує перебіг післяопераційного періоду та попереджає розвиток спайкового процесу.
В статье освещен современный взгляд на процесс образования, лечения и профилактики перитонеальных тазовых спаек. Известно, что спаечная болезнь увеличивает риск возникновения кишечной непроходимости, бесплодия, хронической тазовой боли и хирургических осложнений, поэтому целью данного исследования является создание алгоритма профилактики возникновения спаечной болезни у пациенток в ранний послеоперационный период.
Ключевые слова: тазовые спайки, гинекология, хирургия, лапаротомия, лапароскопия.
Pathogenetic approaches to the prevention of peritoneal pelvic adhesions
A.A. Sukhanova, N.Ya. Ratushnyak, O.A. Sorokina
The article highlights the modern view on the process of education, treatment and prevention of peritoneal pelvic adhesions. It is known that adhesive disease increases the risk of intestinal obstruction, infertility, chronic pelvic pain and surgical complications, therefore the purpose of this study is to create an algorithm for preventing the occurrence of adhesive disease in patients in the early postoperative period.
Key words: pelvic adhesions, gynecology, surgery, laparotomy,laparoscopy.
СПИСОК ЛІТЕРАТУРИ
- Аюшинова Н.И., Лепехова С.А., Шурыгина И.А. и др. Способ моделирования спаечного процесса в брюшной полости // Патент на изобретение RUS 2467401 27.07.2011.
- Бебуришвили А.Г., Воробьев А.А., Михин И.В. и др. Спаечная болезнь брюшной полости //Эндоскопическая хирургия. – 2003. – № 1. – С. 51–62.
- Беженарь В.Ф., Байлюк Е.Н., Цыпурдеева А.А. Клиническое значение противоспаечных барьеров в профилактике образования спаек у гинекологических больных // Журнал акушерства и женских болезней. – 2009. – Т. LVIII. – Вып. 5:М3.
- Бурлев В.А., Дубинская Е.Д., Гаспаров А.С. Перитонеальные спайки: от патогенеза до профилактики // Проблемы репродукции. – 2009. – № 3. – С. 36–44.
- Верхулецкий И.Е., Верхулецкий Е.И. Аспекты морфологии и классификации спаечного процесса органов брюшной полости // Украинский журнал хирургии. – 2009. – № 3. – С. 30–33.
- Кулаков В.И., Адамян Л.В., Мынбаев О.А. Послеоперационные спайки (этиология, патогенез и профилактика). – М: Медицина, 1998. – 528 с.
- Матвеев Н.Л., Арутюнян Д.Ю. Внутрибрюшные спайки – недооцениваемая проблема (обзор литературы) // Эндоскопическая хирургия. – 2007. – T. 13, № 5. – С. 60–69.
- Попов А.А., Мананникова Т.Н., Шагинян Г.Г. Спаечная болезнь как проблема репродукции и методы ее профилактики // Российский вестник акушера-гинеколога. – 2005. – № 4. – С. 41–45.
- Серов В.В. Воспаление. Руководство для врачей / Под ред. В.В. Серова, В.С. Паукова. – М.: Медицина, 1995. – 219 с.
- Хусаинова В.Х., Федорова Т.А., Волков Н.И. Диагностика, лечение и профилактика спаечного процесса в малом тазу у женщин с трубно-перитонеальной формой бесплодия // Гинекология. – 2003. – Т. 5, № 2. – С. 117–122.
- Чекмазов И.А. Спаечная болезнь органов брюшной полости (патогенез, клиника, диагностика, лечение и профилактика): Дис. …д-ра мед. наук: 14.00.47 / Чекмазов И.А. [Место защиты: Центральный научно-исследовательский институт гастроэнтерологии]. – М., 2004. – 195 с.
- Мамчур В.И. Два препарата, один организм – механизмы взаимодействий при коморбидной патологии //Фармакология и лекарственная токсикология. – 2013. – № 6 (36). – С. 27–55.
- Di Zerega G.S., Campeau J.D. Peritoneal repair and post-surgical adhesion formation // Human reproduction update. – 2001. – № 6. – Vol. 6. – Р. 547–555.
- Gutt et al. Fewer adhesions induced by laparoscopic surgery? // Surg. Endosc. – 2004. – 18. – Р. 898–906.
- Kuhry E. et al. Long-term outcome of laparoscopic surgery for colorectal cancer: a cochrane systematic review of randomised controlled trials // Cancer Treat Rev. – 2008. – Oct; 34(6). – Р. 498–504.
- Lundorff et al. Adhesion formation after laparoscopic surgery in tubal pregnancy: a randomized trial versus laparotomy // Fertil Steril. – 1991. – 55 (5). – Р. 911–915.
- De Cherney A.H., di Zerega G.S. «Clinical problem of intraperitoneal postsurgical adhesion formation following general surgery and the use of adhesion prevention barriers.» Surg Clin North Am,77(1997):671-688.
- Stricker B., Blanco J., Fox H.E. «The gynecologic contribution to intestinal obstruction in females.» J Am Coll Surg,178(1994):617-620.
- Drollette C.M., Badawy S.Z. Pathophysiology of pelvic adhesions: Modern trends in preventing infertility // J. Reprod. Med. – 1992. – № 3. – P. 107–122.
- Ellis H. The clinical significance of adhesions: Focus on intestinal obstruction // Eur. J. Surg. Suppl. – 1997. – № 577. – Р. 5–9.
- Lalountas M.A., Ballas K.D., Skouras C., et al. Preventing intraperitoneal adhesions with atorvastatin and sodium hyaluronate/carboxymethylcellulose: a comparative study in rats // Am. J. Surg. – 2010. – Vol. 200. – № 1. – P. 118– 112.
- Whang S.H., Astudillo J.A., Sporn E., et al. In search of the best peritoneal adhesion model: comparison of different techniques in a rat model // J. Surg. Res. – 2011. – Vol. 167, № 2. – P. 245–25.
Share the post "Патогенетичні підходи до профілактики перитонеальних тазових спайок"


