О. А. Вільцанюк, М. В. Мазур
Вінницький національний медичний університет ім. М. І. Пирогова
© Вільцанюк О. А., Мазур М. В.
ОБҐРУНТУВАННЯ ЕФЕКТИВНОСТІ ЗАСТОСУВАННЯ РЕКТАЛЬНИХ СУПОЗИТОРІЇВ «ДАЛМАКСІН» (ТІОТРИАЗОЛІН) ПРИ КОМПЛЕКСНОМУ ЛІКУВАННІ ГОСТРОГО ПАРАПРОКТИТУ
Резюме. Проблема лікування гострого гнійного парапроктиту є однією з найбільш актуальних проблем сучасної колопроктології.
Мета дослідження. Провести оцінку ефективності застосування ректальних супозиторіїв «Далмаксін» у комплексному лікуванні гострого парапроктиту.
Матеріали та методи. Ефективність застосування ректальних супозиторіїв «Далмаксін» проведено у 62 хворих з гострим підшкірним парапроктитом, які були розподілені на дві групи основну — 30 хворих та групу порівняння — 32 хворих. Усім хворим проводили радикальне оперативне втручання. Після операції призначали антимікробну, дезінтоксикаційну та симптоматичну терапію. Місцеве лікування гнійних ран проводилось з використанням мазей на гідрофільній основі, хворим основної групи додатково призначали ректальні супозиторії «Далмаксін» два рази на добу. Ефективність лікування оцінювали за вираженістю набряку, характером виділень з рани, рівнем мікробного забруднення, термінами очищення ран, появою грануляційної тканини та епітелізацією та за допомогою цитологічного дослідження. Ендогенну інтоксикацію (ЕІ) та її зміни в процесі лікування оцінювали за рівнем молекул середньої маси, лейкоцитарного індексу інтоксикації та гематологічного показник інтоксикації. Статистичну обробку і порівняння отриманих даних проведено за допомогою інтегральної системи STATISTICA® 5.5(STAT+SOFT® Snc, USA), ліцензія А XX 910A374605FA.
Результати. Проведене дослідження показало, що у хворих на гострий парапроктит важкість перебігу післяопераційного періоду обумовлена наявністю важкої інтоксикації та розвитком синдрому системної запальної відповіді, які були виявлені у хворих на момент госпіталізації. Після оперативного втручання тільки з п’ятої доби відбувалося поступове зниження показників рівня ЕІ і лабораторних показників. При порівнянні отриманих результатів лікування гострого парапроктиту у хворих з використанням ректальних супозиторіїв «Далмаксін» з традиційними методиками виявлено, що перебіг післяопераційного періоду у цій групі хворих мав більш сприятливий перебіг. Терміни перебування хворих в стаціонарі також були менші ніж в групі порівняння і складали (9,2 ± 0,5) проти (11,9±0,9) ліжко днів.
Висновки. Проведена порівняльна оцінка використання «Далмаксіну» у комплексному лікуванні гострого гнійного парапроктиту показала, що препарат за рахунок своїх властивостей значно покращує перебіг післяопераційного періоду, про що свідчило більш швидке зниження ендогенної інтоксикації, зменшення мікробної забрудненості і очищення ран від некротичних тканин, більш швидка поява грануляцій, епітелізації та загоєння ран і тим самим сприяє скороченню термінів перебування хворих в стаціонарі.
Ключові слова: гострий парапроктит, комплексне лікування, тіотриазолін, ректальні супозиторії «Далмаксін».
Вступ
В останні десятиріччя в Україні, як і в більшості цивілізованих країн світу, відмічається зростання показників захворюваності на колопроктологічну патологію, частина якої серед хвороб органів травлення складає 15 % [World Gastroenterology Organisation, 2016]. Найбільш поширеними захворюваннями анального каналу і тканин промежини на сьогодні є геморой, анальні тріщини, нориці прямої кишки та гострий парапроктит, які складають від 20 до 41 % від інших колопроктологічних захворювань [1, 2, 3]. На сьогодні хворі з гострим парапроктитом займають четверте місце після геморою, анальної тріщини і коліту, які складають 38-41 % хворих з екстреною хірургічною патологією товстої кишки, та за даними різних авторів від 10 до 50 % усіх колопроктологічних захворювань [4].
Не дивлячись на впровадження сучасних методик лікування гострого парапроктиту у 1320 % хворих в післяопераційному періоді виникає велика кількість ускладнень [5, 6]. Без сумніву, основним методом лікування цієї патології, залишається хірургічний метод, але перебіг післяопераційного періоду потребує використання комплексного підходу та цілого ряду засобів, які допомагають уникнути ускладнень та забезпечити одужання хворих [7, 8, 9]. При цьому особливої уваги потребує ведення післяопераційного періоду у хворих з супутньою патологією і особливо у хворих з імуносупресією, лікування яких після операції потребує призначення препаратів, які мають політропну дію [9. 10, 11].
Такою речовиною вітчизняного виробництва є сіль тіазотної кислоти, що була розроблена співробітниками НВП «Фарматрон» та Запорізького медичного університету і широко використовується у різних галузях медицини [12]. Однією з лікарських форм тіотриазоліну є ректальні свічки «Далмаксін», використовуються у гінекології при лікуванні запальних захворювань органів малого тазу [13]. Але до цього часу практика використання Далмаксіну у колопроктології при лікуванні гострого парапроктиту ще не набула широкого розповсюдження.
Мета досліджень
Провести оцінку ефективності застосування ректальних супозиторіїв «Далмаксін» у комплексному лікуванні гострого парапроктиту.
Матеріали та методи досліджень
Дослідження ефективності застосування ректальних супозиторіїв «Далмаксін» у комплексному лікуванні гострого парапроктиту та гострого підшкірного парапроктиту проведено у 62 хворих у віці від 19 до 68 років, з яких жінок було 12 (19,4 %) і чоловіків 50 (80.6 %). Хворі були розподілені на дві групи: основну – 30 хворих та групу порівняння – 32 хворих. Всім пацієнтам проводили радикальне оперативне втручання, яке полягало в наступному: після проведення адекватного знеболення проводили розкриття гнійного вогнища та ліквідацію внутрішнього отвору в ділянці анальної крипти. Порожнини гнояків піддавались ревізії, при цьому виявлялись запливи і кишені, які при необхідності розкривались додатковими розтинами, видаляли залишки некротичних тканин. Після цього проводили санацію порожнин гнояка розчинами антисептиків та дренували гумовими дренажами або поліхлорвініловими трубками.
Після проведення радикального оперативного втручання та обробки гнійного вогнища, хворим призначали парентеральне введення антибіотиків, дезінтоксикаційну та симптоматичну терапію. Місцеве лікування гнійних ран, в післяопераційному періоді, у хворих обох груп проводилось з використанням мазей на гідрофільній основі, в залежності від фаз ранового процесу [14]. Хворим основної групи додатково призначали ректальні супозиторії «Далмаксін», які вводили в пряму кишку два рази на добу протягом всього терміну перебування в стаціонарі, а в подальшому до 14 діб.
Ефективність лікування хворих у післяопераційному періоді оцінювали за допомогою загальновідомих клінічних критеріїв (загального стану, ознак інтоксикації, температури тіла), динаміки перебігу ранового процесу (вираженістю перифокального набряку, інфільтрації тканин, характеру виділень з рани, термінів очищення ран, появи грануляційної тканини та епітелізації). Крім цього, залучали дані лабораторних досліджень, які включали вивчення бактеріологічного забруднення ран, цитологічного дослідження ран за методиками рекомендованими Даценко Б. М. [15].
Усім хворим, перед операцією та у післяопераційному періоді проводились загальні лабораторні та біохімічні дослідження у такому об’ємі: загальний аналіз крові з визначенням рівня гемоглобіну, кольорового показника, кількості еритроцитів і лейкоцитів, лейкоцитарної формули, швидкості осідання еритроцитів; загальний аналіз сечі з вивченням її фізико-хімічних властивостей та проведенням мікроскопічного дослідження осаду, кількісне визначення білка проводилось способом Стольнікова, цукру поляриметричним методом. При біохімічних дослідженнях визначався загальний білок сироватки крові біуретовою реакцією, креатиніну – за реакцією Яффе (метод Поппера), сечовини сироватки – за кольоровою реакцією з діацетилмонооксидом, наборами «БасБета» [16, 17].
Ендогенну інтоксикацію (ЕІ) та її зміни в процесі лікування оцінювали за рівнем молекул середньої маси (МСМ) в сироватці крові, які визначали спектрофотометричним методом при довжині хвилі 254 нм і представляли в умовних одиницях (УО), рівних одиниці екстинції [18]. Лейкоцитарний індекс інтоксикації (ЛІІ) та гематологічний показник інтоксикації (ГПІ) визначали за методиками Каль-Каліфа та Васильєва [19, 20]. Статистичну обробку отриманих даних проводили з визначенням середніх величин. Результати отримані в різних групах хворих порівнювали, при цьому для визначення їх відмінностей використовували t-критерій Стьюдента [21]. Для проведення статистичної обробки отриманих даних було використано інтегральну систему STATISTICA® 5.5 (STAT+SOFT® Snc, USA), ліцензія за номером А XX 910A374605FA.
Результати досліджень та їх обговорення
На момент госпіталізації загальний стан у хворих основної групи та групи порівняння був важким. Турбували болі в прианальній ділянці, відмічалось підвищення температури тіла, тахікардія, загальна слабкість, спрага, порушення сну. При лабораторному дослідженні відмічався нейтрофільний лейкоцитоз, підвищення ШОЕ та зміни показників біохімічних досліджень. Показники ЕІ у всіх госпіталізованих хворих внаслідок патологічного процесу були високими. Так на момент госпіталізації рівень МСМ складав (0,467+0,02) од. екст., ЛІІ — (6,43 ± 0,24) ум.од. Після проведеного оперативного втручання загальний стан хворих дещо покращувався, але в цілому залишався важким. Температура тіла в обох групах хворих залишалась підвищеною і була на рівні 37,5-38,0 °С. Післяопераційні рани були з некротичними тканинами. Суттєвих змін в лабораторних дослідженнях крові не спостерігалось, мікробна забрудненість ран була на рівні 107 КУО/г тканини і складала (4,0±0,8)х107 в основній групі та (3,9 ±0,3)х107 КУО/г тканини в групі порівняння.
Після проведення розтину гнійних вогнищ, цитологічна картина в мазках – відбитках, взятих з післяопераційних ран, до проведення місцевого лікування у хворих обох груп, носила запальний характер. При мікроскопічному дослідженні в (91,0+2,9) % виявлялись переважно нейтрофільні лейкоцити з дегенеративними змінами. Кількість неушкоджених клітин в мазках-від битках складала всього (8,4±1,2) %, виявлялись поодинокі макрофаги, кількість яких складала всього (0,5±0,3) %. Мікроорганізми вільно лежали між зміненими нейтрофільними лейкоцитами, виявлялись нитки фібрину та значна кількість тканинного детриту. Фагоцитарна активність нейтрофілів майже не спостерігалась. При мікроскопії, в окремих полях зору, зустрічались поодинокі лейкоцити з фагоцитованими але не перевареними бактеріями.
На третю добу після операції, загальний стан хворих обох груп покращувався, вранці температура тіла знижувалась до 37,1 °С, але в вечірній час ще підвищувалась до 37,5 °С. Пов’язки продовжували промокати серозно-гнійним вмістом. Післяопераційні рани були з некротичними тканинами, але в основній групі, у окремих хворих, рани частково очищались від некротичних тканин і з’являлись острівці грануляцій. В обох групах хворих рівень ЕІ залишався підвищеним. Рівень МСМ в периферійній крові залишався підвищеним, як в основній групі, так і в групі порівняння, та достовірно не відрізнявся від показників перед операцією. Але в основній групі він був дещо нижчим ніж в групі порівняння і складав (0,454 ± 0,012) од. екст. проти (0,469 ± 0,08) од. екст. ЛІІ також був на доволі високому рівні і складав (5,34 ± 0,9) ум. од., тоді як в групі порівняння – (6,63 ± 0,8) ум. од. Рівень ГПІ також знижувався і достовірно (р<0,05) відрізнявся від показників на момент госпіталізації, але в основній групі він був достовірно (р<0,05) нижчим, ніж в групі порівняння і складав (16,9±1,8) ум. од., проти (17,9±2,51) ум. од.
В мазках-відбитках з ран у хворих групи порівняння кількість незмінених нейтрофільних лейкоцитів зростала до (33,0±2.3) %, кількість дегенеративно змінених клітин зменшувалась до (65,0±0,7) %, з’являлись поодинокі фагоцитарно активні клітини, але фагоцитоз в більшості випадків носив незавершений характер. Цитологічна картина свідчила, що починаються регенераторні процеси: з’являлись незрілі мононуклеари – до (1,5 ± 0,6) %, хоча кількість достовірно не відрізнялась (р < 0,05) від попереднього терміну спостереження, зустрічались поодинокі фібробласти. В мазках – відбитках спостерігались вільно розташовані бактерії у вигляді скупчень, відмічалась наявність ниток фібрину та тканинного детриту. В основній групі, на третю добу після операції, відсоток неушкоджених нейтрофілів складав (79,0 ± 3,95) дегенеративно змінених нейтрофілів — (9,0 ± 0,7) %, а кількість фагоцитарно активних клітин складала (1,5±0,3) %. В цих клітинах спостерігався завершений фагоцитоз, тоді як в (25,0±0,3) % клітин відмічався незавершений фагоцитоз. Незрілі мононуклеари складали (4,5 ± 0,6) %, макрофаги – (3,5 ± 0,1) %, що було достовірно вище (р<0,05), ніж в групі порівняння. На відміну від групи порівняння, в основній групі, на цей термін спостереження, в мазках — відбитках виявлялись поодинокі нитки фібрину та незначна кількість тканинного детриту.
На 5-6 добу після операції загальний стан хворих був задовільний. Температура тіла в групі порівняння була на рівні 37,3 °С, тоді як у хворих основної групи була 36.9 °С. Інфільтрація тканин навколо післяопераційної рани набувала зворотного розвитку і в основній групі майже не визначалась, а в групі порівняння інфільтрація тканин хоча і зменшилась, але ще визначалась в тканинах навколо післяопераційної рани. Кількість виділень з рани зменшились і вони носили серозний характер. Післяопераційні рани в основній групі очищались від некротичних тканин і були вкриті грануляційною тканиною, з’являлись ознаки крайової епітелізації ран. В групі порівняння післяопераційні рани також очищались від некротичних тканин, але у всіх хворих в ранах визначались ділянки з некротичними тканинами, а в місцях де не було некротичних тканин виявлялись в’ялі грануляції. Мікробна забрудненість післяопераційних ран в основній групі була на рівні (1,9±103) КУО/г тканини, та (2,5±104) КУО/г тканини в групі порівняння , що було достовірно вище (р<0,05) ніж в основній групі. Разом з покращенням загального стану хворих на 5-у добу після операції покращились і показники ЕІ. Так рівень МСМ в основній групі знижувався до (0,345+0,019) од. екст. проти (0,408 ± 0,05) од екст., в групі порівняння і був достовірно (р<0,05) нижчим ніж в групі порівняння. ЛІІ в основній групі був достовірно нижчим (р<0,05) ніж в групі порівняння і складав (3,86±0,1) ум. од. проти (4,32 ± 0,3) ум. од. у групі порівняння. Достовірно швидше знижувався і рівень ГПІ в основній групі і був на рівні (10.7+1,1) ум. од., а в групі порівняння — (12.8+2,1) ум. од. Про активацію процесів репаративної регенерації в основній групі свідчили дані цитологічного дослідження. Цитограми поступово набували регенераторного характеру в обох групах, при цьому ці процеси були більш вираженими в основній групі, де хворі в післяопераційному періоді отримували «Далмаксін». На 5-ту добу спостереження, у пацієнтів з групи порівняння цитологічна картина ранового ексудату майже не відрізнялась від попереднього терміну спостереження, хоча кількість неушкоджених нейтрофілів зростала до (48.5+3.1) % та збільшувалась кількість фагоцитуючих клітин, але переважав незавершений фагоцитоз. На цей термін спостереження кількість незрілих мононуклеарів збільшувалась до (2.0±0,3) %, збільшувалось число макрофагів до (1,5±0,15) % та кількість фібробластів. Кількість бактерій зменшувалась, хоча інколи спостерігались їх невеликі скупчення. Також в мазках-відбитках зменшувалась кількість ниток фібрину та тканинного детриту, тоді як у основній групі на 5-ту добу спостереження кількість нейтрофільних лейкоцитів в рановому вмісті достовірно зменшувалась (р<0,05) в порівнянні з попереднім терміном спостереження, при цьому 80 % клітин була без дегенеративних змін і в основній масі клітин спостерігався активний фагоцитоз. У порівнянні з групою хворих, яким проводилось звичайне лікування, достовірно (р< 0,05) зростала кількість незрілих мононуклеарів до (7,5 ± 0,3) %, а також макрофагів до (5.0 ± 0,1). Крім цього, кількість юних фібробластів досягала (3,5 ± 0,07) %, а зрілих (2,5 ±0,3) %, з’явились фіброцити, кількість яких складала (1,0 ± 0,02) %. Мікроорганізми вільно лежали між клітинними елементами, зустрічались в окремих полях зору у вигляді поодиноких клітин. Аналогічно, як у хворих в групі порівняння, зустрічались окремі нитки фібрину, але тканинний детрит був відсутній.
На 7-му добу післяопераційного періоду загальний стан хворих в обох групах значно покращувався, в порівнянні з попередніми термінами спостереження температура тіла була на рівні нормальних показників. Показники ЕІ в основній групі суттєво відрізнялись від показників в групі порівняння і складали: МСМ — (0,268±0,017) од. екст. проти (0,301±0,015) од. екст., ЛІІ — (2,03±0,2) проти (3,07±0,4) ум. од., ГПІ — (3,4±0,9) ум. од. проти (4,9±0,71) ум. од., гіперемії, набряку та інфільтрації навколишніх тканин в основній групі хворих не спостерігалось, але в групі порівняння у 5-ох хворих ще спостерігалась незначна інфільтрація тканин. Післяопераційні рани в основній групі повністю очистились від некротичних тканин і виповнювались соковитими, яскраво-червоними грануляціями. Спостерігалась інтенсивна крайова епітелізація, а в групі порівняння процеси крайової епітелізації були менш вираженими. Якщо в основній групі цитограмми носили явно регенераторний характер і мікробна забрудненість ран характеризувалась наявністю одиничних бактерій, то в групі порівняння мікробна забрудненість ран складала (2,8±0,7)х102 КУО/г тканини, крім того у окремих хворих на рановій поверхні виявлялись острівці з некротичних тканин, що підтверджувалось даними цитологічного дослідження. В мазках-відбитках число нейтрофільних гранулоцитів зменшувалось, хоча в 27-32 % ще залишились дегенеративно змінені форми та спостерігався незавершений фагоцитоз. Кількість незрілих мононуклеарів зростала до (2,3±0,1) %, а макрофагів до (2,5±0,25) %. Число фібробластів також збільшувалось порівняно з попередніми термінами спостереження, хоча вони були представлені переважно юними формами (їх кількість сягала (1,3±0,1) %). Кількість мікроорганізмів зменшувалась, хоча в деяких полях зору вони спостерігались у вигляді невеликих скупчень. Нитки фібрину не виявлялись, але зустрічались невеликі ділянки, де містився тканинний детрит і тільки до 10-ї доби спостереження цитограми набували регенераторного характеру. Тоді як, в основній групі хворих на 7-му добу спостереження, цитологічна картина набувала чисто регенераторного характеру. Кількість лейкоцитів в мазках- відбитках достовірно зменшувалась (р<0,05) від всіх попередніх термінів спостереження, дегенеративно змінені нейтрофіли не виявлялись. Незрілі мононуклеари складали (8,5±0,2) %, макрофаги – (6,0±0,5) %. Кількість фібробластів в мазках-від битках зростала до 13 %, при цьому юні форми складали (4,0± 0,3) %, зрілі (5,5 ± 0,01) %, а фіброцити – (3,5 ± 0,2) %. Бактерії, нитки фібрину і тканинний детрит не виявлялись.
На кінцеві терміни спостереження, показники ЕІ в основній групі були на рівні нормальних показників, або наближались до норми і складали МСМ — (0.244 ± 0,014) од. екст., ЛІІ — (0,9 ±0,01) ум. од. та ГПІ — (2,1 ± 0,4) ум. од., тоді як в групі порівняння ці показники були достовірно вищі, ніж в основній групі і складали: МСМ — (0,263±0,01), ЛІІ — (1,1±0,02) ум. од. і ГПІ — (3,4±0,67) ум. од. (рис. 1, 2).
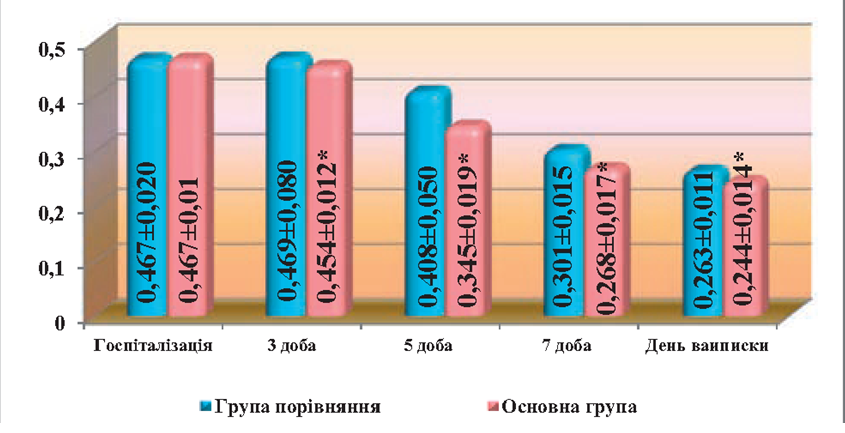
Рис. 1. Порівняльна оцінка динаміки змін рівня метаболітів середньої маси (МСМ) в крові у хворих при лікування гострого парапроктиту з використанням ректального супозиторію «Далмаксін»
Примітка. * різниця достовірна (p<0,05) в порівнянні з групою хворих, які не отримували «Далмаксін».
Порівнюючи отримані результати лікування гострого гнійного парапроктиту у хворих з використанням ректальних супозиторіїв «Далмаксін» та при використанні традиційних методик виявлено, що перебіг післяопераційного періоду у цій групі хворих значно відрізнявся і мав більш сприятливий перебіг (табл. 1).
Як видно з отриманих даних, якщо інфільтрація тканин навколо ран в групі порівняння зберігалась до (6,2±1,4) діб, то в основній групі до (4,8±1,3) діб, рівень мікробної забрудненості ран був нижче критичного рівня на 5-ту добу, тоді як в групі порівняння на 7-му добу, очищення ран від некротичних тканин відбувалось в середньому через (7,5±1,4) діб, а в основній через (5,0±1,5) діб. Рани виповнювались грануляціями та з’являлась крайова епітелізація в основній групі хворих достовірно раніше (р<0,05) ніж в групі порівняння. Середні терміни перебування хворих в стаціонарі також були достовірно нижчі (р<0,05) ніж в групі порівняння і складали (9,2±0,5) проти (11,9±0,9) ліжко днів, що майже на 3 ліжко дні менше ніж в групі порівняння.
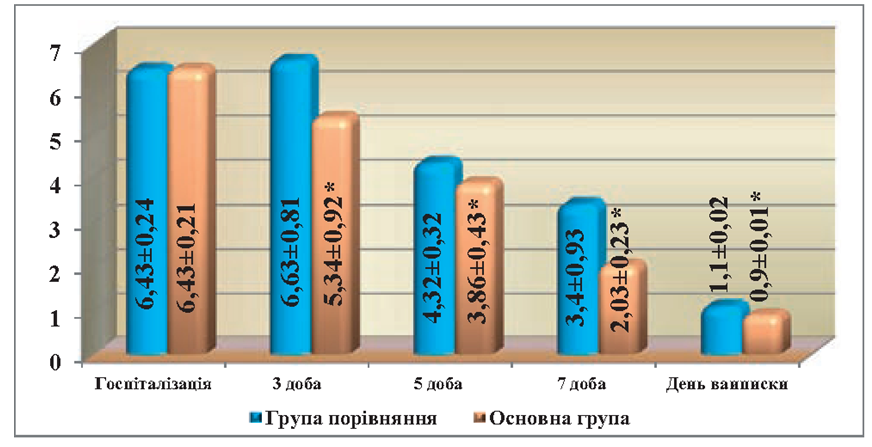
Рис. 2. Порівняльна оцінка динаміки змін рівня лейкоцитарного індексу інтоксикації (ЛІІ) в крові у хворих при лікування гострого парапроктиту з використанням ректального супозиторію «Далмаксін»
Примітка: * різниця достовірна (p < 0,05) в порівнянні з групою хворих, які не отримували «Далмаксін».
Таблиця 1
Порівняльна оцінка результатів лікування гострого парапроктиту з використанням ректального супозиторію «Далмаксін»
| № п/п | Назва показника | Група порівняння (n=32) | Основна група (n=30) |
| 1. | Інфільтрація тканини | 6,2 ± 1,4 | 4,8 ± 1,3* |
| 2. | Очищення рани від некротичних тканин | 7,5 ± 1,4 | 5,0 ± 1,5* |
| 3. | Епітелізація ран | 7,0 ± 0,5 | 5,4 ± 1,0* |
| 4. | Термін перебування хворих в стаціонарі | 11,9 ± 0,9 | 9,2 ± 0,5 * |
Примітка: * різниця достовірна (р<0,05) у порівнянні з групою хворих, які не отримували «Далмаксін».
Проведене дослідження показало, що у хворих на гострий парапроктит важкість перебігу післяопераційного періоду обумовлена наявністю важкої інтоксикації та розвитком синдрому системної запальної відповіді, які були виявлені у хворих на момент госпіталізації. При цьому, навіть після проведеного оперативного втручання, в перші п’ять діб післяопераційного періоду, нормалізації клініко-лабораторних показників не відбувається і тільки з п’ятої доби післяопераційного періоду відбувалось поступове зниження показників рівня ЕІ, які на момент виписки наближались до нормальних показників. Така ж сама картина спостерігалась і з загально-клінічними показниками. Причиною таких змін в першу чергу можна вважати наявність синдрому ЕІ, який ускладнює перебіг післяопераційного періоду. За даними літератури, високий рівень ендогенної інтоксикації та наявність синдрому системної запальної відповіді негативно впливає на перебіг післяопераційного періоду при гнійно-запальних процесах за рахунок впливу на імунну систему, послаблюючи в першу чергу ланку гуморального імунітету, гальмуючи процеси репаративної регенерації та негативно впливає на роботу органів та систем, що приводить до прогресування гнійно-запального процесу та потребує проведення повторних оперативних втручань і може бути причиною смерті хворих з гнійно-запальними процесами [22, 23, 24, 25]. Отримані дані свідчать про те, що хворі, прооперовані з приводу парапроктиту в післяопераційному періоді потребують додаткового включення в схеми лікування засобів, які мали б політропну дію. Ми застосовували ректальні супозиторії «Далмаксін».
Порівнюючи отримані результати лікування гострого парапроктиту з використанням ректальних супозиторіїв «Далмаксін» у післяопераційному періоді виявлено, що перебіг післяопераційного періоду у цій групі хворих значно відрізнявся і мав більш сприятливий перебіг, про що свідчило більш швидке зниження ендогенної інтоксикації, зменшення мікробної забрудненості і очищення ран від некротичних тканин та більш швидка поява грануляцій, епітелізації та загоєння ран. Проведена оцінка використання супозиторіїв «Далмаксіну» у порівнянні зі стандартною терапією при комплексному лікуванні гострого гнійного парапроктиту показала, що включення препарату у схему лікування значно покращує перебіг післяопераційного періоду і тим самим сприяє скороченню термінів перебування хворих в стаціонарі.
Висновки
Застосування препаратів, що мають політропну дію доцільно у післяопераційному періоді. «Далмаксіну» в комплексному лікуванні гострого парапроктиту дозволило знизити рівень ендогенної інтоксикації, зменшити терміни перебування хворих в стаціонарі та прискорити загоєння ран за рахунок стимуляції процесів репаративної регенерації тканин.
Перспективи подальших досліджень
Отримані дані свідчать про доцільність подальшого вивчення препарату при лікуванні інших патологічних процесів в колопроктології.
ЛІТЕРАТУРА
- Isemberg G. A. Anorectal diseas / G.A. Isemberg G.A. // Clinics in Colon and Rectal surgery. — 2011.- 24(1) — P. 3 -4.Doi:10.55/s-0031 -1272817.
- Javier P.Gilbert Systematic rewiev with meta analisis: inflammatory bowel diseas in tht everly / Javier P.Gilbert //Alimentary Pharmacology and Tyerapeuticus.- 2014. -vol.39,issue 5 — P.459-477. https://doi.org / 10.1111./ apt.126616.
- Захараш М.П. Сучасні методи хірургічного лікування поєднаної патології анального каналу і прямої кишки / М. П. Захараш, В. В. Балицький, Е. Г. Курик // Шпитальна хірургія. Журнал імені Л.Я.Ковальчука. — 2017.- №4- с.89 — 94. Doi: 10.11603/2414 -4533.2017.48439.
- Демянов А. В. Острый парапроктит / А. В. Демянов, А. А. Андреев // Вестник экспериментальной и клинической хирургии. -2013. — Т.У1, № 4 — с.526 -534.
- Abcarian H. Anorectal Infection: Abscesses —Fistula / Abcarian H.//Clin.Colon Rectal Surg. -2011.-V.24, N 1 — p 14-21.
- Чарышкин А.Л. Результаты лечения больных острым парапроктитом / А. Л. Чарышкин, И.Н.Дементьев // Фундаментальные исследования. — 2013 – № 7-2. – С. 428-431.
- Тамм Т. I. Местное лечение послеоперационных ран у больных острым парапроктитом препаратом Дистрептаза /Т. И. Тамм, А. Б. Даценко, Е. Ю. Бабец, Е. Г. Даценко // Здоровье мужчины. -2012. – №3. – с.110-111.
- Мусин А. И. Особенности тактики лечения острого парапроктита / А. И. Мусин, И. В. Костарев // Анналы хирургии — 2017- т.22№2- с.81-87. Doi: http://dx.doi. org /10.18821/1560-9502-2017-22-2-81-87.
- Острый парапроктит лечебная тактика, хирургическое лечение / П. М. Лаврешин, В. К. Гоберджишвили, О. В. Владимирова, А. В. Жабина // Здоровье и образование в ХХ1 веке. -2017-т19, №11.- с.65-69. Dоі: http://dx.doi.org /10.26787/пуаіїа-2226-7425-2017-19-11.
- Абдулаев М. Ш. Острий парапроктит у больных сахарным диабетом /М. Ш. Абдулаев А. Б. Мансурова // Колопроктология. – 2012. – № 1. – С. 46-51.
- Власов А.П. Озонотерапия в комплексном лечении острого парапроктита /А. П. Власов, И. В. Кулыгина //Современные проблемы науки и образования. -2013. -№1. -с. 48-49.
- Белиничев И.Ф. Место тиотриазолина в галерее современных метаболитных препаратов /И. Ф. Белиничев, В. А. Визир, В. И. Мамчур, А. В. Курята // Запорожский медицинский журнал. -2019. -т.21, №1 (112)- с.118- 128.БОІ: 1014739/2310-1210.2019.1.155.855.
- Сімрок В.В. Місцеве застосування тіотриазоліну в комплексній терапії доброякісних процесів матки / В.В.Сімрок // Здоровье женщины.- 2013.- №1 (77) -с.165-167.
- Кондратенко П.Г. Хирургическая инфекция: практическое руководство / П.ГКондратенко, В.В.Соболев. -Донецк: Новий світ, 2007.-512 С.
- Теория и практика местного лечения гнойных ран [Безугла О.П., Белов С.Г., Гунько В.Г. и др.] / Под ред. Б.М.Даценко. — К.Здоров’я,1995. — 384С.
- Лабораторные методы исследования в клинике: Справочник / В. В. Меньшиков, Л.Н. Делекторская, Р.П. Золотницкая и др. / Под ред. В.В. Меньшикова. — М.: Медицина, 1987. — 386с.
- Медицинские лабораторные технологии / Под ред.. А.И.Карпищенко. — СПб.: Интермедиа, 2002. — 600с.
- Габриэлян Н.И. Опыт использования показателей средних молекул в крови для диагностики нефрологических заболеваний у детей /Н. И. Габриэлян, В. И. Менатов // Лабораторное дело. – 1984. – № 3. С. 138 – 140.
- Каль-Калиф Я. Я. О лейкоцитарном индексе интоксикации и его практическое значение/ Я.Я.Каль-Калиф // Врачебное дело. – 1941. – № 1. – С. 31 — 33.
- Васильев В. С. Критерии оценки тяжести болезни и выздоровления при скарлатине / В.С.Васильев, // Здравохранение Белоруссии. – 1993. -№ 2. – С. 38 — 40.
- Реброва О.Ю. Статистический анализ данных. Применение пакета прикладных программ 8ТАТІ8ТІСА: Монография / Реброва О.Ю. — М.: Медиа Сфера, 2003. — 312 с.
- Галкин А. А. Повреждение защитных функций нейтрофилов на ранней стадии ожоговой болезни /А.А.Галкин, В.С.Демидова // Успехи современной биологии -2012-т.132 ,№3 – С.297-311.
- Феофанов О.Д. Порушення функції нейтрофілів та стану ПОЛ в патогенезі гнійно-септичних захворювань у дітей / О.Д.Феофанов, Я.Д. Матяш, А.П.Юрцева, А.В.Теслюк //Галицький лікарський вісник.-2002.-т.9, №3.- С.300-301.
- Значение клеточного состава и цитокин продуцирующей активности клеток раневого отделяемого у больных с острыми одонтогенными воспалительными заболеваниями челюстно-лицевой области [Текст] /А.В.Лепилин, Н.Б. Захарова, Д.А. Федотенкова, Н.Е., Терешкина // Саратовский научно-медицинский журнал. — 2015. — № т.11, №2. — С. 173—177.
- Comparative Evaluation of C-Reactive Protein and WBC Count in Fascial Space Infections of Odontogenic Origin [Text] / R. Bagul, S. Chandan, V.D. Sane, S.Patil, D.Yaday // J. Maxillofac. Oral Surg. — 2017. — Vol. 16. — P. 238-242. Doi: 101007/s12663-016-0953-z22
- Антиоксиданты: Клинико-фармакологические аспекты /И.СЧекман, И.Ф.Белиничев, Н.А.Горчаков и др. //Український медичний часопис. -2014.-№1 — с.22-28.
- Отчет об экспериментальном изучении специфической (ранозаживляющей и гепатопротекторной) активности тиотриазолина /В.Р.Стец, С.М.Дороговоз, Т.Ф.Сарбаш и др. —Запорожье, 1990.-40с.
- Інструкція для медичного застосування лікарського препарату Далмаксін. Реєстраційне посвідчення UA/7595/01/01. Наказ МОЗ №1030 від 08.05.2019.
Share the post "ОБҐРУНТУВАННЯ ЕФЕКТИВНОСТІ ЗАСТОСУВАННЯ РЕКТАЛЬНИХ СУПОЗИТОРІЇВ «ДАЛМАКСІН» (ТІОТРИАЗОЛІН) ПРИ КОМПЛЕКСНОМУ ЛІКУВАННІ ГОСТРОГО ПАРАПРОКТИТУ"

